登录/
注册
登录/
注册
盐酸噻氯匹定
Yansuan Sailupiding
Ticlopidine Hydrochloride
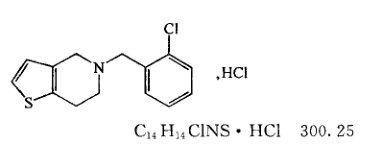
本品为5-[(2-氯苯基)甲基]-4,5,6,7-四氢噻吩并[3,2-c]吡啶盐酸盐。按干燥品计算,含C14H14ClNS•HCl应为98.0%~102.0%。
本品为白色或类白色结晶性粉末;无臭,味微咸。
本品在甲醇或三氯甲烷中溶解,在水中略溶,在丙酮中极微溶解;在冰醋酸中易溶。
①预防和治疗因血小板高聚集状态所致心、脑及其他动脉的循环障碍性疾病,如短暂性脑缺血发作(TIA)、缺血性脑卒中、冠心病及间歇性跛行。②血管内支架置入术后,用于预防支架内血栓形成(与阿司匹林合用)。
口服 一次250mg,一日1次。对支架置入术患者可给予一次250mg,一日2次;2周后减为一次250mg,一日1次;进餐时服。
(1)药效学 本品为噻吩并吡啶类血小板聚集抑制药。血小板的活化受多种因素的影响,其中二磷酸腺苷(ADP)起重要作用。当ADP与其特异性受体结合后,可活化血小板膜表面的纤维蛋白原受体(糖蛋白Ⅱb/Ⅲa受体),并使其结合纤维蛋白原进而引起血小板聚集(第一相聚集)。另外,血小板活化后又可释放ADP,导致血小板进一步聚集(第二相聚集)。噻氯匹定对ADP诱导的血小板聚集(包括第一相和第二相聚集)有强力的抑制作用,对聚集功能已被抑制的血小板其作用是不可逆的。此外,噻氯匹定尚可降低纤维蛋白原浓度与血液黏滞性。
(2)药动学 口服本品后80%以上由肠道迅速吸收,进餐时服药更可进一步提高其生物利用度。口服250mg,达峰时间为2小时,峰值1.33~1.99mmol/L。本品蛋白结合率甚高,为98%。主要与血中白蛋白及脂蛋白结合。本品由肝脏代谢,其代谢产物主要由肾脏(60%)及粪便(25%)排出。其消除半衰期因年龄与用药方式而异。单次给药 250 mg,20~43岁者为7.9小时;65~76岁者为12.6小时。多次给药,一次250mg;一日2次,20~43岁者约4天;65~76岁者约5天。常规用药2天后即可测得血小板聚集抑制,但临床明显见效(抑制>50%)一般在4天之后,达最强作用(抑制>60%~70%)需用药8~11天。停药后出血时间及其他血小板功能多于1~2周内恢复正常。
(1)血液系统 本品最严重的不良反应为粒细胞减少症;偶尔可发生血小板减少症,可单独发生或与粒细胞减少症同时发生;罕见全血细胞减少者。多出现在用药后3个月内。另外,少见但严重的不良反应为血栓性血小板减少性紫癜。
(2)出血 因血小板聚集受抑制或血小板减少所致。
(3)胃肠道反应 可引起恶心、腹泻及胃肠不适,一般为轻度,不需停药,1~2周多自行消失。极少数病例腹泻严重,可合并结肠炎,应停药。
(4)皮疹 呈斑丘疹或荨麻疹,伴瘙痒,一般在用药后3个月内(平均在11天)发生,停药后几天内可消失。
(5)极少数出现药物性肝炎和胆汁淤积性黄疸,停药后一般可恢复。
(6)个别患者发生免疫反应性改变,如脉管炎、系统性红斑狼疮等。
对本品有过敏史、血友病或其他出血性疾病患者,粒细胞或血小板减少症、溃疡病及活动性出血患者均禁忌使用本品。
(1)本品可以透过胎盘屏障及进入母乳,应避免用于妊娠期和哺乳期妇女。美国FDA妊娠期用药安全性分级为B。
(2)为避免外科及口腔科择期手术中出血量增多,术前10~14日应停用本品。若术中出现紧急情况,可输注新鲜血小板以帮助止血。静脉注射甲泼尼龙20mg 可使出血时间在2小时内恢复正常。
(3)严重的肝功能损害患者,由于其凝血因子合成障碍,因此往往增加出血的危险,故不宜使用本品。
(4)严重的肾功能损害患者,由于肾小球清除率降低,导致血药浓度升高,增加出血危险,并可加重肾功能损害。故使用本品时应密切监测肾功能,必要时可减量。
(5)用药期间应定期监测血象,最初4~6周每周1 次,以后每2周1次。一旦出现白细胞或血小板减少即应停药,并继续监测至恢复正常。
(6)美国FDA黑框警示:本品可引起致命性血液系统不良反应,包括中性粒细胞减少、血栓性血小板减少性紫癜和再生障碍性贫血,因此,用药的前3个月必须严密监测血液学指标及临床情况。由于本药可引起严重血液系统的不良反应,现已很少应用,一般仅用于对阿司匹林和氯吡格雷过敏或不能耐受的患者。
(1)本品与任何血小板聚集抑制药、溶栓药及导致低凝血酶原血症或血小板减少的药物合用均可加重出血的危险。若临床确有必要联合用药,应密切观察并进行实验室监测。
(2)本品与茶碱合用时,因其降低了后者的清除率,可使茶碱血药浓度升高并有过量的危险。故用本品期间及之后应调整茶碱用量,必要时进行茶碱血药浓度监测。
(3)本品与地高辛合用时会使后者血药浓度轻度下降(约15%)。但一般不会影响地高辛的临床疗效。
(4)偶见报道本品可降低环孢素的血药浓度,故两者合用时应定期进行环孢素血药浓度监测。
盐酸噻氯匹定片:250 mg。
盐酸噻氯匹定胶囊:(1)125mg;(2)250mg。
(1)取本品约1mg,加入甲醛硫酸试液1ml中,液面即显紫红色。
(2)取本品,加水溶解并稀释制成每1ml中约含0.4mg的溶液,照紫外-可见分光光度法(通则0401)测定,在267nm与276nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集640图)一致。
(4)本品显氯化物的鉴别反应(通则0301)。
酸度 取本品0.10g,加水10ml溶解后,依法测定(通则0631),pH值应为3.0~4.5。
酸性溶液的澄清度 取本品0.50g,加盐酸溶液(1→100)20ml溶解后,溶液应澄清;如显浑浊,与1号浊度标准液(通则0902第一法)比较,不得更浓。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,加流动相溶解并稀释制成每1ml中约含0.3mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中含3µg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以0.022%的戊烷磺酸钠溶液(用磷酸调节pH值至3.5)--磷酸盐缓冲液(取磷酸二氢钾6.8g,加900ml水溶解,用磷酸调节pH值至3.0,再加水稀释至1000ml,摇匀)-甲醇-乙腈(26∶55∶23∶15)为流动相;检测波长为220nm;进样体积20μl。
系统适用性要求 理论板数按噻氯匹定峰计算不低于3000。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
限度 供试品溶液色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液主峰面积(1.0%)。
残留溶剂 照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品,精密称定,加二甲基亚砜溶解并定量稀释制成每1ml中约含40mg的溶液。
对照品溶液 取甲苯,精密称定,加二甲基亚砜溶解并定量稀释制成每1ml中约含35.6μg的溶液。
色谱条件 以5%苯基-95%甲基聚硅氧烷为固定液的毛细管柱为色谱柱;柱温为50℃;进样体积1~3μl。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,甲苯的残留量应符合规定。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品约50mg,精密称定,置50ml量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液 取盐酸噻氯匹定对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.1mg的溶液。
色谱条件与系统适用性要求 见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗血小板聚集药。
遮光,密封保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
