登录/
注册
登录/
注册
右佐匹克隆
Youzuopikelong
Dexzopiclone
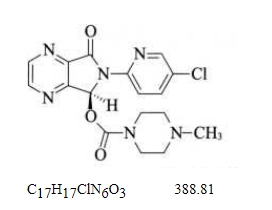
本品为(+)-(7S)-6-(5-氯-2-吡啶基)-7-[(4-甲基哌嗪-1-基)甲酰氧基]-5,6-二氢吡咯并[3,4-b]吡嗪-5-酮。按干燥品计算,含C17H17ClN6O3不得少于98.5%。
本品为白色或类白色结晶或结晶性粉末;无嗅。
本品在三氯甲烷中易溶,在甲醇或丙酮中微溶,在乙醇中极微溶解,在水中几乎不溶,在0.1mol/L盐酸溶液中溶解。
熔点本品的熔点(通则0612)为202~208℃,熔距在4℃以内。
比旋度取本品约0.25g,精密称定,置25ml量瓶中,加丙酮超声溶解并稀释至刻度,摇匀,依法测定(通则0621),比旋度为+131°至+141°。
失眠。
口服①成年人推荐起始剂量为入睡前2mg,可根据临床需要增加到3mg。②主诉入睡困难的老年患者推荐起始剂量为睡前1mg,必要时可增加到2mg。睡眠维持障碍的老年患者推荐剂量为入睡前2mg。③特殊人群:严重肝损患者应慎重使用本品,初始剂量为1mg。④合用CYP抑制剂:与CYP3A4强抑制药合用时,初始剂量不应大于1mg。
(1)药效学 属于环吡咯酮类化合物,但本品是佐匹克隆右旋单一异构体,艾司佐匹克隆对中枢苯二氮草受体的亲和力比佐匹克隆强50倍。选择性作用于苯二氮草受体偶联的GABA受体的A-1亚型、A-2亚型,对A-1亚型受体选择性更强。动物实验和临床应用均显示有镇静、催眠、抗焦虑、肌松和抗惊厥等作用。
(2)药动学 口服吸收迅速,约1小时后血药浓度达峰值。血浆蛋白结合率52%~59%。口服半衰期平均为6小时,约75%经尿液排出,主要为代谢产物,10%为母体药物。口服后经氧化和脱甲基作用被广泛代谢,主要血浆代谢产物为艾司-佐匹克隆-N-氧化物和右旋-N-去甲基佐匹克隆,后者与GABA受体结合能力弱于右佐匹克隆,前者不与该受体结合。肝微粒体酶CYP3A4和cYP2E1参与本品代谢,本品对肝微粒体酶CYPIA2、CYP2A6、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4无抑制作用。高脂肪食物对本品的药时曲线下面积(AUC)及半衰期(t1/2)无影响,但使达峰时间延迟约1小时,峰浓度(Cmax)降低约21%。
主要不良反应为口苦和头晕,其他如瞌睡、乏力、恶心和呕吐等轻度消化系统和中枢神经系统的不良反应。一般持续时间短,症状轻微,不会影响受试者的生活和功能,可自行缓解,停药后症状即可消失。
(1)对本品及其成分过敏、失代偿的呼吸功能不全、重症肌无力、重症睡眠呼吸暂停综合征患者。
(2)美国FDA妊娠期药物安全性分级为口服给药C。
(1)本品应在临睡前服用。
(2)服用镇静催眠药物有可能产生短期记忆损伤、幻觉、协调障碍、眩晕和头晕眼花。服药后及第二天患者应该小心从事危险性工作(如驾驶或操作设备)。
(3)老年和/或虚弱患者使用:老年患者和/或虚弱患者使用镇静催眠药物应考虑到重复使用或对药物敏感引起的运动损伤和/或认知能力损伤。对于此类患者推荐起始剂量为1mg。
(4)哺乳期妇女用药:本品由于具有适当的亲脂性,容易进入大脑,本品及其代谢产物可部分通过胎盘屏障,同时本品在乳汁中浓度可能较高,因此妊娠期妇女及哺乳期妇女慎用此药。
(5)儿童用药:有关18岁以下儿童用药的安全性、有效性尚未确立,不推荐服用此药。
(6)剂量快速减量或者突然停药时,有可能出现戒断症状。
(7)伴有呼吸障碍或其他疾病、抑郁的患者慎用。
与其他精神科药物、抗癫痫药物、抗组胺药物、酒精和其他中枢神经系统抑制剂合用,可能产生额外的中枢神经系统抑制作用。
艾司佐匹克隆片:(1)1mg;(2)2mg;(3)3mg。
(1)取本品,加盐酸溶液(9→1000)溶解并制成每1ml中约含15μg的溶液。照紫外-可见分光光度法(通则0401)测定,在305nm的波长处有最大吸收,在245nm的波长处有最小吸收。
(2)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
(3)在光学异构体检查项下记录的色谱图中,供试品溶液主峰的保留时间应与系统适用性溶液中右佐匹克隆峰的保留时间一致。
有关物质 照高效液相色谱法(通则0512)测定。临用新制。
供试品溶液 取本品适量,加流动相溶解并稀释制成每1ml中约含1.0mg的溶液。
对照溶液精密量 取供试品溶液1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,再精密量取1ml,置10ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液 取右佐匹克隆约10mg,置10ml量瓶中,加甲醇2ml使溶解,加3%过氧化氢溶液0.1ml,水浴加热15分钟,放冷,用流动相稀释至刻度,摇匀。
灵敏度溶液 精密量取对照溶液5ml,置10ml量瓶中,用流动相稀释至刻度,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(DiamonsilC18,250mm×4.6mm,5μm或效能相当的色谱柱),以含0.5%十二烷基硫酸钠和0.01%磷酸二氢钠溶液(用磷酸调节pH值至4.0)-乙腈(625:375)为流动相;检测波长为303nm;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,调节流动相比例,使主成分色谱峰的保留时间约为29分钟,主成分峰与相对保留时间约为0.8处的杂质Ⅰ峰之间的分离度应符合要求。灵敏度溶液色谱图中,主成分峰高的信噪比应大于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的1.5倍。
限度供试品溶液 色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积(0.1%),各杂质峰面积的和不得大于对照溶液主峰面积的5倍(0.5%),小于灵敏度溶液主峰面积的色谱峰忽略不计。
光学异构体 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,加流动相溶解并稀释制成每1ml中约含0.5mg的溶液。
对照溶液精密量 取供试品溶液1ml,置200ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液 取杂质Ⅱ对照品与右佐匹克隆对照品各适量,精密称定,加流动相溶解并定量稀释制成每1ml中各约含2.5μg的溶液。
色谱条件 用CHIRALCELOD-R手性色谱柱;以0.01mol/L磷酸氢二钠溶液(用磷酸调节pH值至6.5)-乙腈(57:43)为流动相;检测波长为305nm;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,右佐匹克隆峰与杂质Ⅱ峰之间的分离度应大于3,理论板数按杂质Ⅱ峰计算不低于3000。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度供试品溶液 色谱图中如有与杂质Ⅱ保留时间一致的色谱峰,其峰面积不得大于对照溶液主峰面积(0.5%)。
残留溶剂 照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品约0.25g,精密称定,置10ml量瓶中,加二甲基亚砜溶解并稀释至刻度,摇匀,离心,取上清液。
对照品溶液分别 取甲醇、乙腈与二氯甲烷各适量,精密称定,用二甲基亚砜定量稀释制成每1ml中分别约含0.75mg、0.10mg、0.15mg的混合溶液。
色谱条件 用6%氰丙基苯基-94%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;起始温度为40℃,维持20分钟,以每分钟40℃的速率升温至200℃,维持4分钟;进样口温度为150℃;检测器温度为220℃;载气为氮气;进样体积1μl。
系统适用性要求 对照品溶液色谱图中,各成分峰之间的分离度应符合要求。
测定法精密量 取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,甲醇、乙腈与二氯甲烷的残留量均应符合规定。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
取本品约0.3g,精密称定,加冰醋酸40ml使溶解,照电位滴定法(通则0701),用高氯酸滴定液(0.1mol/L)滴定,并将滴定结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于38.88mg的C17H17ClN6O3。
镇静催眠药。
密封,在阴凉处保存。
杂质I(佐匹克隆氧化物)
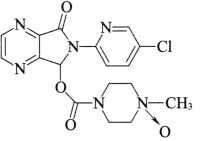
C17H17ClN6O4 404.81
6-(5-氯-2-吡啶基)-7-[(4-甲基-4-氧化哌嗪-1-基)甲酰氧基]-5,6-二氢吡咯并[3,4-b]吡嗪-5-酮
杂质Ⅱ(光学异构体,左佐匹克隆)
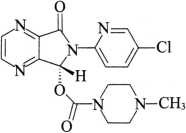
C17H17ClN6O3 388.81
(-)-(7R)-6-(5-氯-2-吡啶基)-7-[(4-甲基哌嗪-1-基)甲酰氧基]-5,6-二氢吡咯并[3,4-b]吡嗪-5-酮
杂质Ⅲ
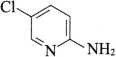
C5H5ClN2 128.56
2-氨基-5-氯吡啶
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
