登录/
注册
登录/
注册
伏格列波糖
Fugeliebotang
Voglibose
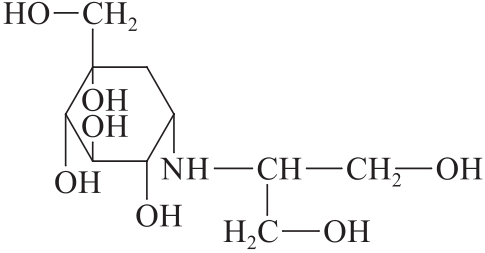
C10H21N07 267.28
本品以井冈霉素A为起始原料,先经微生物发酵,再经过合成工艺制备而得。本品为(+)-(1S,2S,3R,4S,5S)-5-[(1,3-二羟基丙烷-2-基)氨基]1-羟甲基-1,2,3,4-环己四醇。按无水物计算,含C10H21N07不得少于99.5%。
本品为白色结晶或结晶性粉末。
本品在水中极易溶解,在甲醇中微溶,在无水乙醇中几乎不溶;在0.1mol/L盐酸溶液中易溶。
熔点本品的熔点(通则0612)为163~168℃。
比旋度取本品,精密称定,加0.1mol/L盐酸溶液溶解并定量稀释制成每1ml中约含10mg的溶液,依法测定(通则0621),比旋度为+45°至+48°。
用于2型糖尿病,经饮食控制、体育锻炼2~3个月,血糖仍不能满意控制的患者。本品可单独应用,也可与其他降血糖药合用。本品不应单独用于1型糖尿病患者。
口服 成人一日3次,每次常用量0.2mg,餐前服用。
(1)药效学本品为α糖苷酶抑制药,可抑制糖类分解为单糖,从而抑制、延缓糖类的吸收,使餐后高血糖减轻,达到治疗糖尿病的目的。本药的作用方式为选择性的抑制α葡萄糖苷酶,该酶为作用于糖类消化吸收的最后一个步骤——将双糖分解为单糖,主要是葡萄糖的双糖酶。
(2)药动学本品在胃肠道中吸收量甚微,大鼠或狗在饲以14C标记的伏格列波糖(按体重1mg/kg的剂量)后,吸收率分别为6%或3%。本品在体内甚少代谢,主要以原形存在于血浆中,大鼠或狗分别于1小时或4~6小时达到血药峰值,清除半衰期分别为3~10小时或16小时,本品在组织中主要分布在肠黏膜及肾脏。观察患者服伏格列波糖每日3次,每次2mg或5mg,连续10日,血及尿中未能测到此药。
(1)消化系统主要为轻度腹胀、肠鸣音亢进、排气增加、稀便、腹痛、食欲缺乏。
(2)过敏反应偶有皮疹、瘙痒。
(3)其他罕见反应肝酶水平升高(ALT、AST、LDH、GGT)、头痛、困倦、眩晕,颜面部水肿。
(1)有严重酮症酸中毒、严重感染的2型糖尿病患者禁用。
(2)对本品过敏者禁用。
(3)手术前、后的患者禁用。
(1)本品单独应用一般不引起低血糖症,当与其他降血糖药合用时则可能发生。一旦出现低血糖症,应口服或静脉注射葡萄糖治疗;摄入蔗糖无效,因在本品作用下,蔗糖不能分解为葡萄糖,从而不能被吸收。
(2)肝、肾功能损害者,胃肠道手术史、肠梗阻病史者,胃肠道疾病伴消化、吸收障碍者慎用。
(3)儿童、妊娠期妇女、哺乳期妇女均不用此药。
伏格列波糖片:0.2mg。
(1)取本品与伏格列波糖对照品各适量,分别加有关物质项下的流动相溶解并稀释制成每1ml中约含1mg的溶液,照有关物质项下的色谱条件进行试验,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集940图)一致。
碱度 取本品1.0g,加水10ml使溶解,依法测定(通则0631),pH值应为9.8~10.4。
溶液的澄清度与颜色 取本品1.0g,加水10ml使溶解,溶液应澄清无色。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 本品适量,加流动相溶解并稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中约含1μg的溶液。
系统适用性溶液 取伏格列波糖与杂质I对照品、杂质II对照品、杂质Ⅲ对照品各适量,加流动相溶解并稀释制成每1ml中分别约含伏格列波糖1mg及杂质I、杂质II、杂质Ⅲ各10μg的混合溶液。
灵敏度溶液 精密量取对照溶液适量,用流动相定量稀释制成每1ml中约含0.1μg的溶液。
色谱条件 用多氨基键合聚乙烯醇为填充剂(ShodexAsahipakNH2P-504E,4.6mm×250mm,5μm或效能相当的色谱柱),以磷酸盐缓冲液(取二水合磷酸二氢钠1.56g与磷酸氢二钠3.58g,加水1000ml使溶解,用磷酸或氢氧化钠试液调节pH值至6.5)-乙腈(37∶63)为流动相,调节色谱系统使主峰保留时间约为20分钟;用荧光检测器测定,激发波长为350nm,发射波长为430nm;取牛磺酸6.25g与高碘酸钠2.56g,加水溶解并稀释至1000ml,摇匀,作为荧光反应试剂,荧光反应试剂的流速与流动相相同;反应池温度为100℃,反应管长20m(内径0.5mm),冷却池温度为15~25℃,冷却管长2m(内径0.3mm)。进样体积50μl。
系统适用性 要求系统适用性溶液色谱图中,出峰顺序依次为伏格列波糖峰、杂质I峰、杂质II峰、杂质Ⅲ峰,相邻色谱峰之间的分离度均应符合要求;对照溶液色谱图中,理论板数按伏格列波糖峰计算不低于7000;灵敏度溶液色谱图中,伏格列波糖峰信噪比应不小于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度 供试品溶液色谱图中如有杂质峰,杂质I、杂质II、杂质Ⅲ的峰面积分别乘以校正因子2、2、2.5后均不得大于对照溶液主峰面积(0.1%),其他单个杂质峰面积不得大于对照溶液主峰面积(0.1%),各杂质峰面积的和按校正后的峰面积计算不得大于对照溶液主峰面积的2倍(0.2%),小于灵敏度溶液主峰面积的峰忽略不计。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过0.5%。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
取本品约0.2g,精密称定,加冰醋酸-醋酐(2:1)的混合液40ml溶解后,照电位滴定法(通则0701),用高氯酸滴定液(0.1mol/L)滴定,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于26.73mg的C10H21NO7。
降血糖药。
密封保存。
杂质I
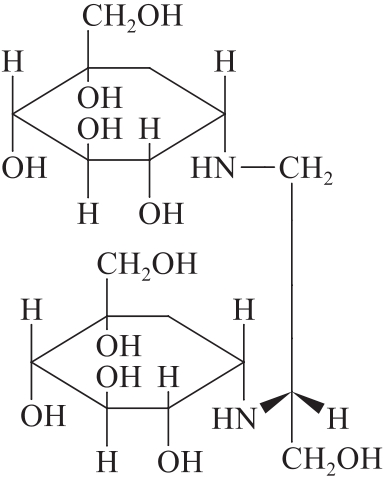
C17H34N2O11442.46
(1S,1'S,2S,2'S,3R,3'R,4S,4'S,5S,5'S)-5,5'-[[(R)-3-羟基丙烷-1,2-二基]双(亚氨二基)]双[1-(羟甲基)-1,2,3,4-环己四醇]
杂质II
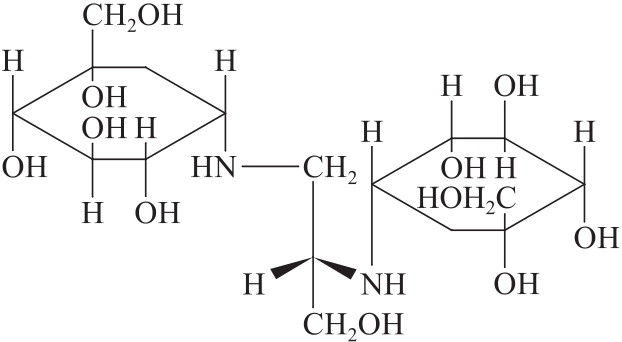
C17H34N2O11 442.46
(1S,1'S,2S,2'S,3R,3'R,4S,4'S,5S,5'S)-5,5'-[[(S)-3-羟基丙烷-1,2-二基]双(亚氨二基)]双[1-(羟甲基)-1,2,3,4-环己四醇]
杂质Ⅲ
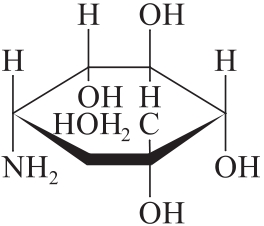
C7H15NO5 193.20
(1S,2S,3R,4S,5S)-5-氨基-1-羟甲基-1,2,3,4-环己四醇(维列胺)
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
