登录/
注册
登录/
注册
头孢拉定
Toubaolading
Cefradine
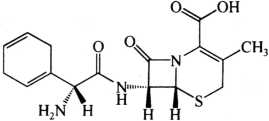
C16H19N3O4S 349.40
本品为(6R,7R)-7-[(R)-2-氨基-2-(1,4-环己二烯-1-基)乙酰氨基]-3-甲基-8-氧代-5-硫杂-氮杂双环[4.2.0]辛-2-烯-2-羧酸。按无水物计算,含头孢拉定(C16H19N3O4S)不得少于90.0%。
本品为白色或类白色结晶性粉末;微臭。
本品在水中略溶,在乙醇或乙醚中几乎不溶。
比旋度取本品,精密称定,加醋酸盐缓冲液(取醋酸钠1.36g,加水约50ml溶解,用冰醋酸调节pH值至4.6,加水稀释至100ml)溶解并定量稀释制成每1ml中约含10mg的溶液。依法测定(通则0621),比旋度为+80°至+90°。
用于敏感细菌所致急性咽炎、急性扁桃体炎、中耳炎、支气管炎、肺炎等呼吸道感染、泌尿与生殖系统感染、皮肤及软组织感染等。本品亦为预防术后伤口感染的选用药物之一。口服制剂用于上述感染的轻症患者。
(1)成人①口服,一次0.25~0.5g,每6~8小时1次,一日最高剂量为4g;②肌内注射,一次0.5~1g,每6~8小时1次;③静脉滴注,每日4~6g,每6~8小时1次,一日最高剂量为8g。
(2)儿童①口服,一次6.25~12.5mg/kg,每6~8小时1次;②肌内注射,一次12.5~25mg/kg,每6~8小时1次;③静脉滴注,每日50~150mg/kg,每6~8小时1次
(3)肾功能减退者肌酐清除率>20ml/min,5~20ml/min和<5ml/min时,其剂量分别为每6小时0.5g、每6小时0.25g和每12小时0.25g。
【儿科用法与用量】(1)口服一日25~50mg/kg,分3~4次服。
(2)肌内注射或静脉滴注一日25~50mg/kg,严重感染者为一日50~150mg/kg;分3~4次。
【儿科注意事项】(1)体外抗菌活性同头孢氨苄。
(2)本药肌内注射局部疼痛明显,应做深部注射。
(3)对肾功能减退患者应减少剂量。
(1)药效学 头孢拉定的体外抗菌活性与头孢氨苄相仿,低于头孢噻吩和头孢唑林。本品对甲氧西林敏感金黄色葡萄球菌、表皮葡萄球菌、化脓性链球菌、肺炎链球菌和草绿色链球菌均有良好抗菌作用,耐甲氧西林葡萄球菌、肠球菌属对本品耐药。本品对革兰阳性菌和革兰阴性菌的作用与头孢氨苄相似,但对大肠埃希菌、变形杆菌属和克雷伯菌属的活性略差。本品对淋病奈瑟菌有一定作用,对产酶淋病奈瑟菌也具有活性;对流感嗜血杆菌的活性较差。除脆弱拟杆菌外,其余厌氧菌大多对本品敏感。
(2)药动学 口服本品后吸收迅速,生物利用度为90%。空腹口服0.5g,tmax为1小时,Cmax为11~18mg/L;食物可延缓本品的吸收,但不影响吸收总量。静脉注射0.5g后5分钟的血药浓度为46mg/L。肌内注射0.5g后,tmax为1~2小时,Cmax为6mg/L,肌内注射吸收显然较口服为差,但血药浓度持续时间较久。头孢拉定在组织和体液中分布良好。在肝组织中的药物浓度与血清浓度相等。在心肌、子宫、肺、前列腺和骨组织中皆可达到有效浓度。在脑组织内药物量少,仅为同时期血药浓度的5%~10%;在脑脊液中的药物浓度更低,静脉滴注2~4g.脑脊液中浓度仅有1.2~1.5mg/L,甚至测不到。本品可通过胎盘屏障进入胎儿循环,少量经乳汁排出。血浆蛋白结合率为6%~10%。本品在体内很少代谢。口服0.5g后,6小时和24小时后自尿中排出给药量的95%和99%。静脉注射后6小时内尿中排出量可达给药量的90%以上。肌内注射后6小时内尿中排出量为给药量的66%,尿药浓度多超过1000mg/L。少量药物自胆汁排泄,其浓度可为同期血药浓度的4倍。t1/2为1小时,肾功能减退时延长。本品能被血液透析和腹膜透析清除。丙磺舒可减少本品经肾排泄。
本品不良反应较轻,发生率约6%。恶心、呕吐、腹泻、上腹部不适等胃肠道反应较为常见。药物疹发生率为1%~3%,个别患者可见假膜性肠炎、嗜酸性粒细胞增多、直接Coombs试验阳性反应、周围血象白细胞减少等。少数患者可出现暂时性血尿素氮升高,血清氨基转移酶、碱性磷酸酶、胆红素、乳酸脱氢酶一过性升高。口服制剂长期应用可能导致菌群失调、维生素缺乏或二重感染,偶见外阴阴道念珠菌病。本品肌内注射疼痛明显,静脉内给药后有发生静脉炎的报道。国内上市后亦有不良反应报道,使用本品可能导致血尿,另曾有极少数病例使用本品出现精神异常、听力减退、迟发性变态反应、过敏性休克、排尿困难、药物性溶血、心律失常等罕见不良反应。
对本品及其他头孢菌素类过敏者禁用。
(1)在应用本品前需详细询问患者对头孢菌素类、青霉素类及其他药物过敏史,有青霉素类药物过敏性休克者不可应用本品,其他患者应用本品时必须注意头孢菌素类与青霉素类存在交叉过敏反应的机率有5%~7%,需在严密监测下慎用。一旦发生过敏反应,立即停用药物。如发生过敏性休克,需立即就地抢救,包括保持气道通畅、吸氧和肾上腺素、糖皮质激素的应用等救治措施。
(2)本品主要经肾排出,肾功能减退时需减少剂量或延长给药间期。国内上市后有不良反应报道使用本品可能导致血尿,在儿童患者中易发生,故肾功能减退者和儿童患者应用本品须谨慎并在监测下用药。
(3)有胃肠道疾病者,特别是结肠炎患者,慎用本品。
(4)应用本品的患者以硫酸铜法测定尿糖时可出现假阳性反应。
(5)美国FDA妊娠期用药安全性分级为口服、注射给药为B。
(1)注射用头孢拉定中含有碳酸钠,因此与含钙溶液(林格液、乳酸盐林格液、葡萄糖乳酸盐林格液)有配伍禁忌。
(2)本品和氨基糖苷类抗生素可相互灭活,当两者同时应用时,应在不同部位给药,两者也不能同瓶滴注。
(3)注射用头孢拉定不宜与其他抗生素或其他药物同瓶滴注。
(4)本品与庆大霉素、阿米卡星等氨基糖苷类抗生素联合有协同作用。
(5)本品与氨基糖苷类、袢利尿药及其他肾毒性药物合用,可使上述药物的肾毒性增加。
(6)丙磺舒可延迟本品自肾脏排泄。
头孢拉定片:(1)0.25g;(2)0.5g。
头孢拉定胶囊(按无水头孢拉定计):(1)0.125g;(2)0.25g;(3)0.5g。
头孢拉定颗粒:(1)0.125g;(2)0.25g。
头孢拉定干混悬剂:(1)0.125g;(2)0.25g;(3)1.5g;(4)3.0g。
注射用头孢拉定:(1)0.5g;(2)1g;(3)2g。
(1)照薄层色谱法(通则0502)试验。
供试品溶液 取本品适量,加水溶解并稀释制成每1ml中约含6mg的溶液。
对照品溶液 取头孢拉定对照品适量,加水溶解并稀释制成每1ml中约含6mg的溶液。
色谱条件采用硅胶G薄层板[经105℃活化后,置5%(ml/ml)正十四烷的正己烷溶液中,展开至薄层板的顶部,晾干],以0.1mol/L枸椽酸溶液-0.2mol/L磷酸氢二钠溶液-丙酮(60:40:1.5)为展开剂。
测定法 吸取供试品溶液与对照品溶液各5μl,分别点于同一薄层板上,展开,取出,于105℃加热5分钟,立即喷以用展开剂制成的0.1%茚三酮溶液,在105℃加热15分钟后,检视。
结果判定供试品溶液所显主斑点的位置和颜色应与对照品溶液所显主斑点的位置和颜色相同。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)取本品适量,加甲醇适量使溶解,于室温挥发至干,取残渣照红外分光光度法(通则0402)测定,本品的红外光吸收图谱应与对照的图谱(光谱集722图)一致。
以上(1)、(2)两项可选做一项。
结晶性 取本品少许,依法检查(通则0981),应符合规定。
酸度 取本品,加水制成每1ml中含10mg的溶液,依法测定(通则0631),pH值应为3.5~6.0。
溶液的澄清度与颜色 取本品5份,各0.55g,分别加碳酸钠0.15g和水5ml溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓;如显色,与黄色或黄绿色5号标准比色液(通则0901第一法)比较,均不得更深。(供注射用)
头孢氨苄照高效液相色谱法(通则0512)测定。
供试品溶液 取本品约70mg,精密称定,置100ml量瓶中,加流动相约70ml超声使溶解,再用流动相稀释至刻度,摇匀。
对照品溶液 取头孢氨苄对照品约20mg,精密称定,置50ml量瓶中,加流动相约30ml超声使溶解,再用流动相稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液 取0.7mg/ml头孢拉定对照品溶液10份和0.4mg/ml头孢氨苄对照品溶液1份,混匀。
色谱条件见有关物质项下。检测波长为254nm;进样体积10μl。
系统适用性要求系统适用性溶液色谱图中,头孢拉定峰和头孢氨苄峰之间的分离度应符合要求。
测定法 精密量取供试品溶液与对照品溶液,分别注入
液相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,含头孢氨苄按无水物计,不得过5.0%。
有关物质照高效液相色谱法(通则0512)测定。临用新制。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中含1mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中含5μg的溶液。
对照品溶液 精密称取头孢氨苄对照品、双氢苯甘氨酸对照品和7-氨基去乙酰氧基头孢烷酸对照品各适量,置同一量瓶中,先加7.3%盐酸溶液4ml,超声使溶解,再用对照溶液定量稀释制成每1ml中含上述3种杂质对照品各10μg的混合溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以水-甲醇-3.86%醋酸钠溶液-4%醋酸溶液(1564:400:30:6)为流动相;流速为每分钟0.7~0.9ml;检测波长为254nm和220nm;进样体积20μl。
系统适用性 要求对照品溶液色谱图中(220nm),洗脱顺序依次为:7-氨基去乙酰氧基头孢烷酸、双氢苯甘氨酸、头孢氨苄和头孢拉定,各峰之间的分离度均应符合要求。
测定法 精密量取供试品溶液、对照溶液与对照品溶液,分别注入液相色谱仪,记录供试品溶液色谱图至主成分峰保留时间的2.5倍。
限度 供试品溶液色谱图中如有杂质峰,除头孢氨苄外,双氢苯甘氨酸(220nm)和7-氨基去乙酰氧基头孢烷酸(254nm)按外标法以峰面积计算,均不得过1.0%;其他单个杂质(254nm)峰面积不得大于对照溶液主峰面积的4倍(2.0%),其他各杂质(254nm)峰面积的和不得大于对照溶液主峰面积的5倍(2.5%)。
头孢拉定聚合物照分子排阻色谱法(通则0514)测定。临用新制。
供试品溶液 取本品约0.2g,精密称定,置10ml量瓶中,加2%无水碳酸钠溶液4ml使溶解,用水稀释至刻度,摇匀。
对照溶液 取头孢拉定对照品适量,精密称定,加水溶解并定量稀释制成每1ml中约含10μg的溶液。
系统适用性溶液(1)取蓝色葡聚糖2000适量,加水溶解并稀释制成每1ml中约含0.2mg的溶液。
系统适用性溶液(2)称取头孢拉定约0.2g,置10ml量瓶中,加2%无水碳酸钠溶液4ml使溶解后,加0.6mg/ml的蓝色葡聚糖2000溶液5ml,用水稀释至刻度,摇匀。
色谱条件 用葡聚糖凝胶G-10(40~120μm)为填充剂;玻璃柱内径1.0~1.4cm,柱长30~45cm;以pH8.0的0.2mol/L磷酸盐缓冲液[0.2mol/L磷酸氢二钠溶液-0.2mol/L磷酸二氢钠溶液(95:5)]为流动相A,以水为流动相B;流速为每分钟1.0~1.5ml;检测波长为254nm;进样体积100~200μl。
系统适用性 要求系统适用性溶液(1)分别在以流动相A与流动相B为流动相记录的色谱图中,按蓝色葡聚糖2000峰计算,理论板数均不低于400,拖尾因子均应小于2.0,蓝色葡聚糖2000的保留时间比值应在0.93~1.07之间。系统适用性溶液(2)在以流动相A为流动相记录的色谱图中,高聚体的峰高与单体和高聚体之间的谷高比应大于2.0。对照溶液色谱图中主峰与供试品溶液色谱图中聚合物峰与相应色谱系统中蓝色葡聚糖2000的保留时间的比值均应在0.93~1.07之间。以流动相B为流动相,精密量取对照溶液连续进样5次,峰面积的相对标准偏差应不大于5.0%。(对照溶液进行测定前,先用含0.2mol/L氢氧化钠与0.5mol/L氯化钠的混合溶液200~400ml冲洗凝胶柱,再用水冲洗至中性。)
测定法 以流动相A为流动相,精密量取供试品溶液注入液相色谱仪,记录色谱图;以流动相B为流动相,精密量取对照溶液注入液相色谱仪,记录色谱图。
限度 按外标法以头孢拉定峰面积计算,头孢拉定聚合物的量不得过0.05%。
2-萘酚照高效液相色谱法(通则0512)测定。
试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含10mg的溶液,充分振摇,滤过,取续滤液。
对照品溶液 取2-萘酚对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.5μg的溶液。
色谱条件用十八烷基硅烷键合硅胶为填充剂;以甲醇-水(55:45)为流动相;流速为每分钟1ml;检测波长为225nm;进样体积20μl。
系统适用性要求对照品溶液色谱图中,2-萘酚峰的保留时间约为7分钟,2-萘酚峰与相邻峰之间的分离度应符合要求。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,2-萘酚的量不得过0.05%(供口服制剂用)或不得过0.0025%(供注射用)。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过6.0%。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.2%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
可见异物 取本品5份,每份各2.0g,加3.0%精氨酸溶液(经0.45μm滤膜滤过)溶解后,依法检查(通则0904),应符合规定。(供无菌分装用)
不溶性微粒 取本品4份,各2.0g,加3.0%精氨酸溶液(经0.45μm滤膜滤过)制成每1ml中含50mg的溶液,依法检查(通则0903),每1g样品中含10μm及10μm以上的微粒不得过6000粒,含25μm及25μm以上的微粒不得过600粒。(供无菌分装用)
细菌内毒素 取本品,加2.6%无内毒素碳酸钠溶液使溶解,依法检查(通则1143),每1mg头孢拉定中含内毒素的量应小于0.20EU。(供注射用)
无菌 取本品,用2.6%无菌碳酸钠溶液溶解并稀释后,经薄膜过滤法处理,依法检查(通则1101),应符合规定。(供无菌分装用)
照高效液相色谱法(通则0512)测定。
对照品溶液取头孢拉定对照品,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.7mg的溶液。
供试品溶液、系统适用性溶液、色谱条件与系统适用性要求见头孢氨苄项下。
测定法精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
β-内酰胺类抗生素,头孢菌素类。
遮光,充氮,密封,在低于10℃处保存。
7-氨基去乙酰氧基头孢烷酸
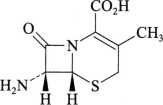
C8H10N2O3S 214.25
(6R,7R)-7-氨基-3-甲基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯2羧酸
双氢苯甘氨酸
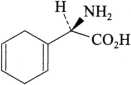
C8H11NO2 153.18
(2R)-氨基(环己-1,4-二烯基)乙酸
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
