登录/
注册
登录/
注册
硫酸阿米卡星
LiusuanAmikaxing
AmikacinSulfate
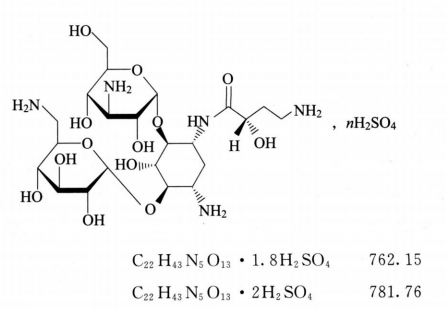
本品为O-3-氨基-3-脱氧-α-D-葡吡喃糖基-(1→4)-O-[6-氨基-6-脱氧-α-D葡吡喃糖基-(1→6)]-N3-(4-氨基-2-羟基-1-氧代丁基)-2-脱氧-L-链霉胺硫酸盐。按干燥品计算,含阿米卡星(C22H43N5O13)应为73.0%~78.4%(n=1.8)或71.1%~76.4%(n=2)。
本品为白色或类白色粉末或结晶性粉末;几乎无臭。
本品在水中极易溶解,在甲醇、丙酮或乙醚中几乎不溶。
比旋度 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含20mg的溶液,依法测定(通则0621),比旋度为+76°至+84°。
①适用于敏感铜绿假单胞菌及其他假单胞菌属、大肠埃希菌、变形杆菌属(吲哚阳性和吲哚阴性)、普罗威登菌属、克雷伯菌属、肠杆菌属、沙雷菌属、不动杆菌属与葡萄球菌属等所致严重感染,如细菌性心内膜炎、血流感染(包括新生儿脓毒血症)、下呼吸道感染、骨与关节感染、皮肤及软组织感染、胆道感染、腹腔感染(包括腹膜炎)、烧伤感染、手术后感染(包括血管外科手术后感染)及反复发作性尿路感染等。临床应用时本品大多与β-内酰胺类或其他抗感染药物联合应用。②阿米卡星对大部分氨基糖苷类钝化酶稳定,故尤其适用于治疗革兰阴性杆菌对庆大霉素或要布霉素耐药菌株所致感染。③阿米卡星不宜用于单纯性尿路感染初治病例。
(1)成人常用量肌内注射或静脉滴注①单纯性尿路感染病原菌对常用抗感染药物耐药者,每12小时0.2g。②用于其他全身性感染,每8小时5mg/kg,或每12小时7.5mg/kg;也可采用一日剂量1次给药的治疗案。成人一日量不超过1.5g,疗程不超过10天。
(2)儿童常用量肌内注射或静脉滴注首剂10mg/kg,继以每12小时7.5mg/kg。
【儿科用法与用量】肌内注射、静脉滴注一日5~10mg/kg,分2~3次。
【儿科注意事项】(1)为氨基糖苷类,主要用于产生严重感染的铜绿假单胞菌及革兰阴性菌。
(2)不宜与同类抗感染药物同时静脉滴注。
(3)高度关注耳毒性、肾毒性,<6岁儿童慎用。
(4)需监测血药浓度。
(1)药效学 氨基糖苷类抗生素在其分子结构中都有一个氨基环醇环和一个或多个氨基糖分子,由配糖键相连接。本类抗生素包括:①由链丝菌属的培养滤液中获得者,如链霉素、新霉素、卡那霉素等;②由小单孢菌属的培养滤液中获得者,如庆大霉素、西索米星等;③半合成氨基糖苷类,如阿米卡星为卡那霉素的半合成衍生物,奈替米星为西索米星的半合成衍生物。
氨基糖苷类抗生素的共同特点为:①水溶性好,性质稳定;②抗菌谱广,对葡萄球菌属、需氧革兰阴性杆菌均具有良好的抗菌活性,某些品种对结核分枝杆菌及其他分枝杆菌属亦有作用;③其作用机制主要为抑制细菌合成蛋白质;④细菌对不同品种之间有部分或完全性交叉耐药;⑤与人血浆蛋白结合率低,大多低于10%;⑥胃肠道吸收差,注射给药后大部分经肾脏以原形排出;⑦具有不同程度肾毒性和耳毒性,后者包括前庭功能损害或听力减退,并可有神经-肌肉接头的阻滞作用。
(2)药动学 肌内注射后迅速被吸收。主要分布于细胞外液,正常婴儿脑脊液中浓度可达同时期血药浓度的10%~20%,当脑膜有炎症时,则可达同期血药浓度的50%;但在心脏心耳组织、心包液、肌肉、脂肪和间质液内的浓度很低;5%~15%的药量重新分布到各种组织,可在肾脏皮质细胞和内耳液中积蕃。可穿过胎盘屏障,尿中药物浓度高,滑膜液中可达有效治疗浓度。支气管分泌物、胆汁及房水中浓度低,腹水中浓度很难预测。分布容积为0.21L/kg,血浆蛋白结合率低,在肾脏皮质中可与组织结合。
肌内注射后tmax为0.75~1.5小时,一次肌注250mg、375mg及580mg后,Cmax分别为12mg/L、16mg/L及21mg/L,肌注后6小时尿药浓度分别为560mg/L,700mg/L及830mg/L。静脉滴注后tmax为15~30分钟,一次静脉滴注500mg,30分钟滴注完毕时的Cmax为38mg/L。发热患者血药浓度减低。成人中t1/2为2~2.5小时,无尿患者中t1/2可长达30小时,烧伤患者中为1~1.5小时;胎儿为3.7小时,新生儿为4~8小时(与出生时体重和年龄呈反比)。
本品在体内不代谢。主要经肾小球滤过排出,9小时内排出84%~92%;一次肌内注射0.5g.尿药浓度可高达800mg/L以上,24小时内排出94%~98%,10~20天内完全排泄。血液透析与腹膜透析可自血液中清除相当量的药物,从而使消除半衰期显著缩短。
(1)耳毒性主要影响前庭功能,亦可影响听力。肾毒性比其他氨基糖苷类药物略轻。
(2)肌内注射后发生口唇周围感觉异常者并不少见,周围神经病变、视神经炎、视野盲点等神经系统症状偶有发生。鞘内注射后可导致脊神经根炎、蛛网膜炎、神经根痛、下肢麻痹等脑脊髓膜炎症状。肾损害或肾前性氮质血症患者发生神经毒性的风险较大。
(3)可发生严重多形性红斑、中毒性表皮坏死剥脱性皮炎及其他皮肤过敏反应。
(4)呼吸困难、嗜睡、软弱无力(神经-肌肉阻滞、肾毒性所致)罕见。
(5)发生率较高者为听力减退、耳鸣或耳部胀满感(耳毒性:影响听力);血尿、排尿次数减少或尿量减少、食欲缺乏、极度口渴(肾毒性);步履不稳、眩晕(耳毒性:影响前庭功能);恶心或呕吐(耳毒性:影响前庭功能,肾毒性);麻木、针刺感或面部烧灼感(周围神经炎);视力减退(视神经炎)。再生障碍性贫血、中性粒细胞缺乏症罕见。
对本品或其他氨基糖苷类过敏者禁用。
(1)交叉过敏反应对一种氨基糖苷类过敏的患者,可能对其他氨基糖苷类也过敏。
(2)老年患者应用氨基糖苷类后可产生各种毒性反应,因此在氨基糖苷类疗程中监测肾功能(最好测定肌酐清除率)极为重要。肾功能正常者用药后亦可能产生听力减退。
(3)疗程中或停药后发生听力减退、耳鸣或耳部胀满感者提示有耳毒性可能,应引起注意。
(4)下列情况应慎用本品:①失水,由于可使血药浓度增高,产生毒性反应的可能性增加;②第Ⅲ对脑神经损害,氨基糖苷类可导致听神经和前庭功能损害;③重症肌无力或帕金森病,氨基糖苷类可引致神经-肌肉阻滞作用,加重骨骼肌软弱无力等不良后果;④肾功能损害,氨基糖苷类可引起肾毒性。
(5)对诊断的干扰可使血清ALT、AST、胆红素浓度及乳酸脱氢酶浓度的测定值增高;血钙、镁、钾、钠浓度的测定值可能降低。
(6)对患者应注意监测:①听电图,对老年患者需在用药前、用药过程中定期及长期用药后进行听电图检测,以及时发现高频听力损害;②温度刺激试验,在用药前、用药过程中定期及长期用药后用以检测前庭功能毒性;③尿常规检查和肾功能测定,在用药前、用药过程中定期测定肾功能,以防止严重肾毒性反应。
(7)应监测血药浓度,血药峰浓度超过40mg/L时引起毒性反应的可能性增加;对肾功能不全的患者有条件时应经常监测血药峰浓度,以不超过20~25mg/L为宜(参阅表10-5,表10-6)。
(8)不能测定血药浓度时,应根据内生肌酐清除率调整剂量,内生肌酐清除率可由血肌酐值按照本章氨基糖苷类概论中所附公式计算而得。
(9)给予首次负荷剂量后,有肾功能不全、前庭功能受损或听力减退的患者应减量或停用,由于氨基糖苷类在体内不被代谢,主要由尿液排出,而肾功能不全的患者体内可能产生药物积聚而达到中毒浓度。
(10)逾量处理由于缺少特异性拮抗药,氨基糖苷类过量或引起毒性反应时,主要应用对症疗法和支持疗法,腹膜透析或血液透析有助于从血中清除氨基糖苷类,新生儿也可考虑换血疗法。
(1)对听力的影响大于庆大霉素。氨基糖苷类与β内酰胺类(头孢菌素类与青霉素类)混合可导致相互失活,因此需联合应用上述抗生素时必须分瓶滴注。阿米卡星亦不宜与其他药物同瓶滴注。
(3)阿米卡星不宜与两性霉素B、头孢噻吩钠、呋喃要因钠、磺胺嘧啶钠和四环素等(以上均为注射剂)联合应用,因可发生配伍禁忌。
(3)逾量处理由于缺少特异性拮抗药,阿米卡星过量或引起毒性反应时,主要用对症疗法和支持疗法,腹膜透析或血液透析有助于从血中清除本品。新生儿也可考虑换血疗法。
硫酸阿米卡星注射液:(1)1ml:50mg(5万U);(2)1ml:0.1g(10万U);(3)2ml:0.1g(10万U);(4)2ml:0.2g(20万U)。
注射用硫酸阿米卡星:(1)0.1g(10万U);(2)0.2g(20万U);(3)0.4g(40万U)。
(1)照薄层色谱法(通则0502)试验。
供试品溶液 取本品适量,加水溶解并稀释制成每1ml中约含阿米卡星5mg的溶液。
对照品溶液 取阿米卡星对照品适量,加水溶解并稀释制成每1ml中约含阿米卡星5mg的溶液。
系统适用性溶液 取供试品溶液和对照品溶液,等量混合。
色谱条件与测定法见卡那霉素项下。
系统适用性要求系统适用性溶液应显单一斑点。
结果判定供试品溶液所显主斑点的位置和颜色应与对照品溶液主斑点的位置和颜色相同。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1079图)一致。
(4)本品的水溶液显硫酸盐的鉴别反应(通则0301)。
以上(1)、(2)两项可选做一项。
酸碱度 取本品,加水制成每1ml中约含10mg的溶液,依法测定(通则0631),pH值应为6.0~7.5(n=1.8)或2.0~4.0(n=2)。
溶液的澄清度与颜色 取本品5份,各0.30g,分别加水5ml使溶解,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓;如显色,与黄色或黄绿色2号标准比色液(通则0901第一法)比较,均不得更深。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,加流动相A溶解并稀释制成每1ml中约含阿米卡星5.0mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相A定量稀释制成每1ml中约含阿米卡星50μg的溶液。
系统适用性溶液 取阿米卡星对照品适量,加流动相A溶解并稀释制成每1ml中约含5.0mg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(Spursil柱,4.6mm×250mm,5μm或效能相当的色谱柱);取辛烷磺酸钠1.8g和无水硫酸钠20.0g,加pH3.0的0.2mol/L磷酸盐缓冲液(0.2mol/L磷酸二氢钾溶液,用0.2mol/L磷酸溶液调节pH值至3.0)50ml和水900ml溶解,加乙腈50ml,混匀,作为流动相A;取辛烷磺酸钠1.8g和无水硫酸钠20.0g,加pH3.0的0.2mol/L磷酸盐缓冲液50ml和水850ml溶解,加乙腈100ml,混匀,作为流动相B,按下表进行线性梯度洗脱;流速为每分钟1.3ml;柱温为40℃;检测波长为200nm;进样体积10μl。
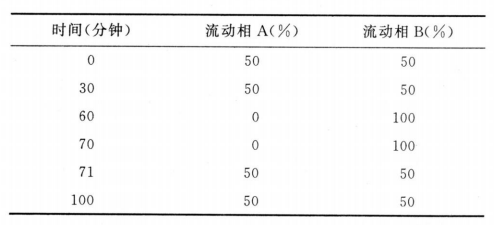
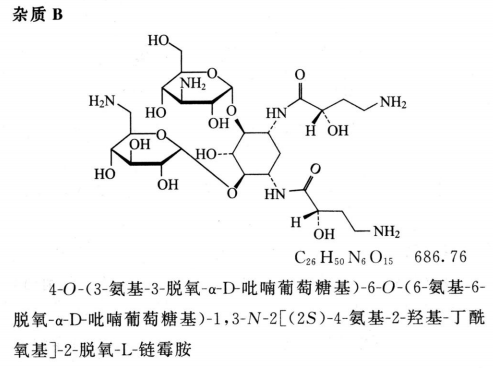
系统适用性 要求系统适用性溶液色谱图中,阿米卡星峰的保留时间应在20~30分钟之间(必要时适当调整流动相A和流动相B的比例),阿米卡星峰与杂质B峰(相对保留时间约为0.92)之间的分离度应符合要求。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
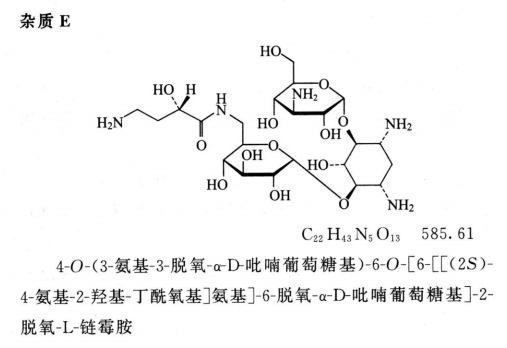
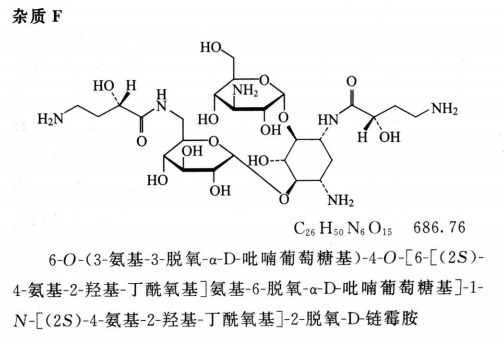
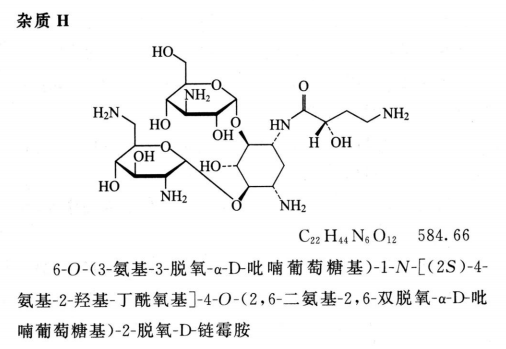
限度 供试品溶液色谱图中如有杂质峰,杂质F(相对保留时间约为0.89)、杂质A(相对保留时间约为1.60,必要时用杂质A对照品确认)与杂质H(相对保留时间约为2.44)均不得大于对照溶液的主峰面积(1.0%),杂质B与杂质E(相对保留时间约为1.41)均不得大于对照溶液主峰面积的0.5倍(0.5%),其他单个杂质峰面积不得大于对照溶液主峰面积(1.0%),各杂质峰面积的和不得大于对照溶液主峰面积的3倍(3.0%)。
卡那霉素照薄层色谱法(通则0502)试验。
供试品溶液 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含阿米卡星25mg的溶液。
对照品溶液 取卡那霉素对照品适量,精密称定,加水溶解并定量稀释制成每1ml中约含卡那霉素0.25mg的溶液。
系统适用性溶液 取阿米卡星与卡那霉素对照品各适量,加水溶解并稀释制成每1ml中分别约含阿米卡星25mg与卡那霉素0.75mg的溶液。
色谱条件采用硅胶G薄层板,以二氯甲烷-甲醇-浓氨溶液(25:40:30)为展开剂。
测定法 吸取上述三种溶液各5μl,分别点于同一薄层板上,展开,晾干,喷以0.2%茚三酮的水饱和正丁醇溶液,在100℃加热数分钟。
系统适用性要求系统适用性溶液中,阿米卡星与卡那霉素斑点应完全分离。
限度 供试品溶液如显卡那霉素斑点,与对照品溶液的主斑点比较,不得更深(1%)。
残留溶剂照残留溶剂测定法(通则0861第一法)测定。
供试品溶液 取本品约0.2g,精密称定,置顶空瓶中,精密加入水5ml使溶解,密封。
对照品溶液 取甲醇、乙醇、丙酮和乙腈各适量,精密称定,用水定量稀释制成每1ml中约含甲醇0.12mg、乙醇0.2mg、丙酮0.2mg和乙腈0.016mg的混合溶液,精密量取5ml,置顶空瓶中,密封。
色谱条件以6%氰丙基苯基-94%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;柱温为40℃;进样口温度为140℃;检测器温度为250℃;顶空瓶平衡温度为80℃,平衡时间为30分钟。
系统适用性要求对照品溶液色谱图中,各主峰间的分离度均应符合要求。
测定法 取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,甲醇、乙醇、丙酮与乙腈的残留量均应符合规定。
硫酸盐 取本品约0.25g,精密称定,加水100ml使溶解,用浓氨溶液调节pH值至11,精密加氯化钡滴定液(0.1mol/L)10ml及酞紫指示液5滴,用乙二胺四醋酸二钠滴定液(0.05mol/L)滴定,注意保持滴定过程中的pH值为11,滴定至紫色开始消褪,加乙醇50ml,继续滴定至紫蓝色消失,并将滴定的结果用空白试验校正,每1ml氯化钡滴定液(0.1mol/L)相当于9.606mg硫酸盐(SO4)。本品含硫酸盐按干燥品计算应为21.0%~24.0%(n=1.8)或22.8%~26.0%(n=2)。
干燥失重 取本品,以五氧化二磷为干燥剂,在110℃减压干燥3小时,减失重量不得过13.0%(通则0831)。
可见异物 取本品5份,每份为制剂最大规格量,加微粒检查用水溶解,依法检查(通则0904),应符合规定。(供无菌分装用)
不溶性微粒 取本品,加微粒检查用水溶解,依法检查(通则0903),每1g样品中,含10μm及10μm以上的微粒不得过6000粒,含25μm及25μm以上的微粒不得过600粒。(供无菌分装用)
细菌内毒素 取本品,依法检查(通则1143),每1mg阿米卡星中含内毒素的量应小于0.33EU。(供注射用)
无菌 取本品,用适宜溶剂溶解并稀释后,经薄膜过滤法处理,依法检查(通则1101),应符合规定。(供无菌分装用)
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含阿米卡星2.5mg的溶液。
对照品溶液 取阿米卡星对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含阿米卡星2.5mg的溶液。
色谱条件用十八烷基硅烷键合硅胶为填充剂(Spursil柱,4.6mm×250mm,5μm或效能相当的色谱柱);取辛烷磺酸钠1.8g和无水硫酸钠20.0g,加pH3.0的0.2mol/L磷酸盐缓冲液(0.2mol/L磷酸二氢钾溶液,用0.2mol/L磷酸溶液调节pH值至3.0)50ml和水875ml溶解,加乙腈75ml,混匀,作为流动相;流速为每分钟1.3ml;柱温为40℃;检测波长为200nm;进样体积10μ1。
系统适用性要求对照品溶液色谱图中,阿米卡星峰的保留时间应在20~30分钟之间,阿米卡星峰与相邻杂质峰之间的分离度应符合要求。
测定法精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算供试品中C22H43N5O13的含量。1mg的C22H43N5O13相当于1000阿米卡星单位。
氨基糖苷类抗生素。
严封,在干燥处保存。

1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
