登录/
注册
登录/
注册
盐酸表柔比星
YansuanBiaoroubixing
EpirubicinHydrochloride
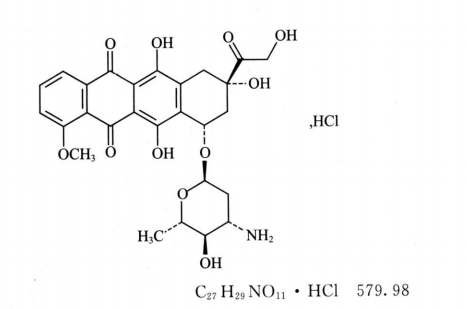
本品为(8S,10S)-10-[(3-氨基-2,3,6-三脱氧-a-L-阿拉伯吡喃糖基)氧]-6,8,11-三羟基-8-(羟基乙酰基)-1-甲氧基-7,8,9,10-四氢并四苯-5,12-二酮盐酸盐。按无水与无溶剂物计算,含盐酸表柔比星(C27H29NO11·HCl)应为97.0%~102.0%。
本品为红色或橙红色粉末;有引湿性。
本品在水或甲醇中溶解,在乙醇中微溶,在乙醚中不溶。
比旋度 取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含0.5mg的溶液,依法测定(通则0621),按无水与无溶剂物计算,比旋度为+310°至+340°。
吸收系数 取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含15µg的溶液,照紫外-可见分光光度法(通则0401),在495nm的波长处测定吸光度,按无水与无溶剂物计算,吸收系数(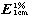 )为200~230。
)为200~230。
主要用于各种急性白血病和恶性淋巴瘤、乳腺癌、支气管肺癌、卵巢癌、肾母细胞瘤、软组织肉瘤、膀胱癌、睾丸癌、前列腺癌、胃癌、肝癌(包括原发性肝细胞癌和转移性癌)以及甲状腺髓样癌等多种实体瘤。
缓慢静脉注射或动脉内注射。临用前用氯化钠注射液溶解制成2mg/ml浓度的溶液。也可再用0.9%氯化钠注射液100~250ml稀释后静脉滴注。在进行肝动脉插管介入治疗时,可用碘化油混合以期增强疗效。
成人每疗程按体表面积50~60mg/m²,3~4周后重复(腔内化疗可于2~3周后重复)。①乳腺癌:每疗程按体表面积60~100mg/m²,2~3周重复。每疗程剂量可一次给予,也可等分于1~3日内分次给药或于
每疗程第1、8日等分给药。②软组织肉瘤:每疗程按体表面积60~100mg/m²,持续静脉滴注72~96小时,每3周重复。联合化疗时一般可用单剂量的2/3。总剂量不宜超过700~800mg/m²。
【儿科用法与用量】静脉注射25~45mg/m²,每3周1次。
【儿科注意事项】总量不超过800mg/m²,以免造成心肌损害。
(1)药效学 本品为多柔比星的主体异构体,是多柔比星氨基糖部分中C'4羟基的反式构型,它既可直接嵌入DNA,与DNA的双螺旋结构形成复合物,阻断依赖于DNA的RNA形成;又有其C'4羟基易与葡糖醛酸酶结合,这可能是本品在体内清除较快而其毒性较同剂量多柔比星为低的主要原因。
(2)药动学 本品体内代谢和排泄较多柔比星快,其分布相半衰期(t1/2α)、消除相半衰期(t1/2β)和终末相半衰期(t1/2γ)分别为3.1~4.8分钟、1.3~2.6小时和20~40小时。主要在肝脏代谢,经胆汁排泄。48小时内9%~10%的给药量由尿排出,4日内40%的给药量由胆汁排出。该药不通过血-脑屏障。对有肝转移和肝功能受损的患者,该药在血浆中的浓度维持时间较长,故应适当减小剂量。肾功能正常与否对本品的药代动力学特性影响不大。
(1)常见者为脱发(见于70%~80%的患者)、骨髓抑制(见于50%~60%,白细胞可于用药后10~14日降至最低点,多在3周左右逐渐恢复,贫血和明显血小板减少罕见),食欲缺乏、恶心、呕吐,但在与多柔比星相当剂量比较下,其程度较多柔比星为轻。
(2)心肌毒性也较多柔比星为轻,其发生率和严重程度与本品累积量成正比。用药后虽常见心律异常、心动过速等,但多为一过性而很快恢复;迟发的严重心力衰竭大多在用药后半年以后或总剂量逾700~800mg/m²时发生,应注意这种严重心肌损害有时可突发而无任何先兆,甚至常规心电图亦无异常发现。监测左心室射血分数(LVEF)和左室射血前期与左室射血时间之比(PEP/LVET)最为敏感。
(3)注射处如有药液外溢,可导致红肿、局部疼痛甚至蜂窝织炎或坏死。
(4)肝、肾功能损害罕见,但在本有慢性肝病或肝转移时可引起血清ALT升高甚或黄疸。
禁用于因用化疗或放疗而造成明显骨髓抑制的患者;已用过大剂量蒽环类药物(如多柔比星或柔红霉素)的患者禁用;近期或既往有心脏受损病史的患者禁用。禁用于血尿患者膀胱内灌注。美国FDA妊娠期药物安全性分级为肠道外给药D。
(1)本品在动物中有潜在的致畸变、致突变和致癌作用,但对人则缺乏明确的证据。
(2)本品使用后有一定量经肾排泄,高龄患者或肾功能严重不全者宜酌减剂量。
(3)用本品后偶可出现肝功能损害,特别是丙氨酸氨基转移酶(ALT)的增高甚或出现黄疸。如有上述情况宜暂时停药,俟黄疸消退、肝功能恢复正常后再继续用药。如实在不能停药,用量应相应减少。
(4)下列情况慎用:以往用过足量柔红霉素、多柔比星,或对此二药呈过敏反应者;周围血象白细胞低于3.5×109/L或血小板低于50×109/L;发热或严重感染;心、肺或肝、肾功能失代偿者;年逾65岁或2岁以下幼儿以及原有心肌病变者。
(5)用药前需全面测定心脏功能,除监测心电图外,有条件时可加做超声心动图和血清肌酸磷酸激酶活力测定,LVEF和PEP/LVET等检查。每次用药前一定要监测心电图。本药总剂量不能超过800mg/m²。
(6)每7~10日检查周围血象1次,每1~2个月复查肝功能1次。
(7)用药期间应多饮水,用药后可给予止呕药预防胃肠道反应。
(8)本品在保存和用药时应避光。
(1)如与其他化疗药同用,应避免相互接触和放入同一容器内给药,与严重抑制骨髓的亚硝脲类、丝裂霉素等同用应酌减用量,与大剂量环磷酰胺(大于1g)或胸部放疗同用更应减量。
(2)不能与肝素溶液混合,否则可形成沉淀。也不能长期与碱性溶液接触。
(3)不宜与地塞米松或琥珀酸氢化可的松同时静脉滴注。
(4)氨茶碱与本品接触可使溶液变成紫蓝色。
(5)与头孢菌素类药物配伍产生沉淀。
(6)在用本品期间,最好避免同时应用任何可能导致心脏或肝脏功能损害的药物(含这类抗癌化疗药物),以避免增加用本品后可能发生的心肌或肝功能损害。
(7)本品可能与柔红霉素和多柔比星呈交叉耐药性;与环磷酰胺、氟尿嘧啶、甲氨蝶呤、顺铂等可发生协同作用。
(8)用本品治疗时慎行疫苗接种。
盐酸表柔比星注射液:5ml:10mg。
注射用盐酸表柔比星;(1)10mg;(2)50mg。
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取吸收系数项下的溶液,照紫外-可见分光光度法(通则0401)测定,在234nm、252nm、288nm、479nm和495nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1022图)一致。
(4)取本品10mg,加硝酸0.5ml使溶解,加水0.5ml,火焰灼烧2分钟,放冷,滴加硝酸银试液,即生成白色凝乳状沉淀。
酸度 取本品,加水制成每1ml中含5mg的溶液,依法测定(通则0631),pH值应为4.0~5.5。
溶液的澄清度 取本品5份,各10mg,分别加水5ml溶解后,溶液应澄清;如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,加流动相溶解并稀释制成每1ml中约含0.5mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中约含5µg的溶液。
系统适用性溶液 取多柔比星酮、盐酸多柔比星与盐酸表柔比星各适量,加流动相溶解并稀释制成每1ml中分别约含多柔比星酮30µg、盐酸多柔比星30µg与盐酸表柔比星100µg的混合溶液。
色谱条件 用三甲基硅烷键合硅胶为填充剂;以乙腈-水-甲醇-85%磷酸溶液(290:540:170:1)并含0.2%十二烷基硫酸钠的混合溶液为流动相;流速为每分钟2.0ml;柱温为35℃;检测波长为254nm;进样体积20µ1。
系统适用性 要求系统适用性溶液色谱图中,多柔比星酮、多柔比星、表柔比星依次洗脱,表柔比星峰与多柔比星峰间的分离度应大于2.0,表柔比星峰的拖尾因子应为0.8~1.4。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度 供试品溶液色谱图中如有杂质峰,多柔比星酮按校正后的峰面积计算(乘以校正因子0.7)不得大于对照溶液主峰面积(1.0%),多柔比星峰面积不得大于对照溶液主峰面积(1.0%),其他单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),各杂质峰面积(多柔比星酮按校正后的峰面积计算)的和不得大于对照溶液主峰面积的2倍(2.0%)。
残留溶剂乙醇、丙酮与二氯甲烷照残留溶剂测定法(通则0861第一法)测定。
供试品溶液 取本品约0.5g,精密称定,置顶空瓶中,精密加水5ml使溶解,密封。
对照品溶液 取乙醇、丙酮、二氯甲烷各适量,精密称定,用水定量稀释制成每1ml中含乙醇500µg、丙酮500µg与二氯甲烷60µg的混合溶液,精密量取5ml,置顶空瓶中,密封。
色谱条件以5%苯基-95%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;柱温为50℃;进样口温度为200℃;检测器温度为250℃;顶空瓶平衡温度为80℃,平衡时间为30分钟。
系统适用性 要求对照品溶液色谱图中,乙醇、丙酮和二氯甲烷依次出峰,各峰间的分离度均应符合要求。
测定法 取供试品溶液与对照品溶液,分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,乙醇的残留量不得过1.0%,丙酮的残留量不得过1.5%,二氯甲烷的残留量应符合规定。
二氧六环与吡啶照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品适量,精密称定,加水溶解并定量稀释制成每1ml中约含50mg的溶液。
对照品溶液 取二氧六环与吡啶适量,精密称定,用水定量稀释制成每1ml中约含二氧六环38µg与吡啶20µg的混合溶液。
色谱条件以5%苯基-95%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;柱温为100℃;进样体积1µl。
系统适用性 要求对照品溶液色谱图中,二氧六环峰与吡啶峰间的分离度应符合要求。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按外标法以峰面积计算,二氧六环与吡啶的残留量均应符合规定。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过3.0%。
降压物质 取本品,依法检查(通则1145),剂量按猫体重每1kg注射1mg,应符合规定。(供注射用)
细菌内毒素 取本品,依法检查(通则1143),每1mg盐酸表柔比星中含内毒素的量应小于1.1EU。(供注射用)
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.1mg的溶液。
对照品溶液 取盐酸表柔比星对照品,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.1mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗肿瘤抗生素类药。
遮光,密封,在阴凉干燥处保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
