登录/
注册
登录/
注册
磷酸氟达拉滨
LinsuanFudalabin
FludarabinePhosphate
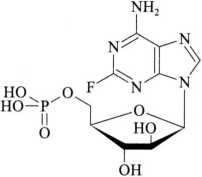
C10H13FN5O7P 365.21
本品为9-β-D-呋喃阿拉伯糖基-2-氟腺嘌呤5'-(磷酸二氢酯)。按无水与无溶剂物计算,含C10H13FN5O7P应为98.0%~102.0%。
本品为白色或类白色粉末或结晶性粉末。
本品在二甲基甲酰胺中易溶,在水中微溶,在乙醇、乙醚中几乎不溶。
本品具有潜在的细胞毒性,避免吸入粉尘或皮肤直接接触。
比旋度 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含5mg的溶液,依法测定(通则0621),比旋度为+10.0°至+14.0°。
用于B细胞性慢性淋巴细胞白血病(CLL)患者的治疗,这些患者接受过至少一个标准的含烷化剂方案的治疗,但在治疗期间或治疗后,病情没有改善或持续进展。还可用于白血病和淋巴瘤的治疗。
静脉使用成人推荐剂量为磷酸氟达拉滨每日25mg/m²,连用5天,每28天为1个静脉疗程。
每支药品用2ml注射用水配制,每1ml配制溶液含有25mg磷酸氟达拉滨。使用注射器抽出按照体表面积计算出的所需药物剂量。如需静脉推注,需再用10ml0.9%氯化钠注射液稀释;如需静脉输注,则使用0.9%氯化钠将所需剂量的药物稀释成100ml溶液,输液时间应持续30分钟以上。
口服每日40mg/m²体表面积,每28天连续服用5天。磷酸氟达拉滨可以空腹服用或伴食物服用。必须用水吞服,不可瞬服或把药片弄碎后服用。
(1)药效学 本品为抗病毒药阿糖腺苷的氟化核苷酸类似物,9-β-D-阿拉伯酸-呋喃基腺嘌呤(ara-A),可相对地抵抗腺苷脱氨基酶的脱氨基作用。磷酸氟达拉滨被快速地去磷酸化成为2F-ara-A,后者可以被细胞摄取,然后被细胞内的脱氧胞苷激酶磷酸化后成为有活性的三磷酸盐2F-ara-ATP。该代谢产物可以通过抑制核苷酸还原酶、DNA聚合酶α、δ和ε,DNA引物酶和DNA连接酶从而抑制DNA的合成。此外,还可以部分抑制RNA聚合酶Ⅱ从而减少蛋白的合成。
(2)药动学 2F-ara-AMP是氟达拉滨(2F-ara-A)的水溶性前体药物,在人体内可以被快速定量的脱磷酸化为核苷酸2F-ara-A。另外一种代谢产物,2F-ara-次黄嘌呤在狗中是主要的代谢物,而在人体中仅仅观测到微量。
通过2Fara-A药代动力学研究之间的比较得出,2F-ara-A平均血浆总清除率(CL)是79ml/(min·m²),个体间的数据差异很大。静脉注射磷酸氟达拉滨后,2F-ara-A血浆浓度和血浆浓度时间曲线下面积(AUC)增加均与药物剂量呈线性关系,而半衰期、血浆清除率和分布容积保持不变,提示与药物剂量无关。
2F-ara-A主要靠肾脏排出,静脉注射剂量的40%~60%通过尿液排出。在实验室动物中用3H-2F-ara-AMP进行的药物总出入量实验发现,从尿液中可以完全回收放射性标记物。
(1)全身症状常见报告有发热、寒战、感染、不适、虚弱和疲倦等症状。
(2)血液和淋巴系统骨髓抑制可以是严重和有累积效应的。磷酸氟达拉滨长时间减少T淋巴细胞计数的作用可以导致机会性感染的危险性增加,机会性感染包括由于潜伏病毒的活化,如进行性多灶性脑白质病。
(3)代谢与营养异常在接受磷酸氟达拉滨治疗的患者中有肿瘤溶解综合征的报告,包括高尿酸血症、高磷酸血症、低钙血症、代谢性酸中毒、高钾血症、血尿、尿酸结晶尿症和肾衰。胁腹疼痛和血尿可以是该综合征的首发症状。
(4)常见有水肿的报告。
(5)呼吸系统常见肺炎发生与磷酸氟达拉滨治疗有关。
(6)消化系统胃肠紊乱,如恶心、呕吐、食欲缺乏、腹泻和胃炎常见。
对本品或其所含成分过敏的患者;肌酐清除率小于30ml/min的肾功能不全患者;失代偿性溶血性贫血的患者;妊娠期及哺乳期妇女。
(1)注意神经毒性。
(2)健康状况差的患者慎用。
(3)注意骨髓抑制,需要严密的血液学监测。
(4)大量肿瘤负荷的患者在接受磷酸氟达拉滨治疗时出现肿瘤溶解综合征。因为磷酸氟达拉滨可以早在治疗的第1周就诱发这一综合征,所以对这种综合征的高危患者应采取预防措施。
(5)在磷酸氟达拉滨治疗期间或治疗后,会出现威胁生命、有时甚至致死的自身免疫现象(如自身免疫性溶血性贫血、自身免疫性血小板减少、血小板减少性紫癜、天疱疮、Evan's综合征)。
(6)如果临床可疑肾功能不全,或是年龄大于70岁的患者均应该检测肌酐清除率。如果肌酐清除率在30~70ml/min之间,药物的剂量应该减半而且要严密监测血液学改变以评价药物毒性。如果肌酐清除率小于30ml/min,应禁用磷酸氟达拉滨治疗。
(7)避孕有生育功能的女性或男性在接受治疗期间或治疗停止后至少6个月必须采取避孕措施。
磷酸氟达拉滨的治疗效果会被双嘧达莫及其他腺苷吸收抑制剂所减弱。
临床研究和体外试验表明,磷酸氟达拉滨和阿糖胞苷联合使用可增加Ara-CTP(阿糖胞苷的活性代谢产物)在白血病细胞内的浓度和细胞外的量。对Ara-C的血液浓度和代谢率无影响。
磷酸氟达拉滨片:10mg。
注射用磷酸氟达拉滨:50mg。
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
酸度 取本品0.10g,加水20ml溶解后,依法测定(通则0631),pH值应为1.5-2.5。
溶液的澄清度与颜色 取本品0.10g,加水20ml溶解后,溶液应澄清;如显色,与黄色1号标准比色液(通则0901第一法)比较,不得更深。
氯化物 取本品30mg,依法检查(通则0801),与标准氯化钠溶液6.0ml制成的对照溶液比较,不得更浓(0.2%)。
游离磷酸盐 取本品约10μg,精密称定,置10ml纳氏比色管中,加水2ml,微热使溶解,作为供试品溶液;精密量取水2ml,置10ml纳氏比色管中,作为空白溶液;精密量取对照溶液(精密称取磷酸二氢钾适量,加水溶解并定量稀释制成每1ml中含0.716mg的溶液,精密量取1ml,置100ml量瓶中,加水稀释至刻度,摇匀)2ml,置10ml纳氏比色管中,作为标准溶液。分别在标准溶液、空白溶液与供试品溶液中加入钒钼试剂(称取钼酸铵4g和钒酸铵0.1g,置150ml烧杯中,加水70ml,搅拌使溶解,加硝酸20ml,混匀,放冷,加水稀释至100ml,摇匀)2ml,摇匀,放置2分钟,以白色为背景,自上向下观察,标准溶液的颜色应比空白溶液的颜色深,供试品溶液如显色,其颜色与标准液比较,不得更深(0.1%)。
钠盐 取本品50mg,置100ml量瓶中,加水溶解并稀释至刻度,摇匀,作为供试品溶液;另量取标准氯化钠溶液(精密称取在105℃干燥2小时的氯化钠127mg,置1000ml量瓶中,加水溶解并稀释至刻度,摇匀)1.0ml,置50ml量瓶中,加供试品溶液稀释至刻度,摇匀,作为对照品溶液。照原子吸收分光光度法(通则0406第二法)在589.0nm的波长处分别测定,应符合规定(0.2%)。
有关物质照高效液相色谱法(通则0512)测定。临用新制。
有关物质I(测定相对保留时间小于1.0的杂质)供试品溶液 取本品适量,加流动相溶解并定量稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中约含2μg的溶液。
系统适用性溶液 取本品约10μg,加0.1mol/L盐酸溶液10ml使溶解,置80℃水浴中加热15分钟,使产生降解产物杂质Ⅰ和杂质Ⅱ,取出,放冷。
灵敏度溶液 精密量取对照溶液适量,用流动相定量稀释制成每1ml中约含0.2μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶(DiamonsilC18色谱柱,4.6mm×150mm,5μm或效能相当的色谱柱)为填充剂,以0.01mol/L磷酸二氢钾溶液-甲醇(94∶6)为流动相,检测波长为260nm;进样体积10μl。
系统适用性 要求系统适用性溶液色谱图中,氟达拉滨峰的保留时间约为10分钟,按杂质Ⅰ、杂质Ⅱ与氟达拉滨顺序出峰(相对保留时间依次约为0.26.0.34与1.0),杂质Ⅰ峰与杂质Ⅱ峰之间的分离度应不小于2.0。灵敏度溶液色谱图中,主成分色谱峰峰高的信噪比应大于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。
限度 供试品溶液色谱图中如有杂质峰,杂质Ⅰ校正后的峰面积(乘以校正因子4.0)不得大于对照溶液主峰面积的4倍(0.8%)、杂质Ⅱ校正后的峰面积(乘以校正因子2.5)不得大于对照溶液的主峰面积(0.2%),相对保留时间约为0.42的杂质校正后的峰面积(乘以校正因子1.9)不得大于对照溶液主峰面积的2倍(0.4%),其他单个未知杂质峰面积均不得大于对照溶液主峰面积的0.5倍(0.1%)。供试品溶液色谱图中小于灵敏度溶液主峰面积的峰忽略不计(0.02%)。
有关物质Ⅱ(测定相对保留时间大于1.0的杂质)供试品溶液、对照溶液与灵敏度溶液见有关物质Ⅰ项下。
系统适用性溶液 取磷酸氟达拉滨系统适用性对照品(含磷酸氟达拉滨和杂质Ⅲ量)适量,加流动相溶解并稀释制成每1ml中含磷酸氟达拉滨约1mg的溶液。
色谱条件 用十八烷基硅烷键合硅胶(ZORBAXEclipseXDB-C18色谱柱,4.6mm×250mm,5μm或效能相当的色谱柱)为填充剂,以0.01mol/L磷酸二氢钾溶液-甲醇(80∶20)为流动相,检测波长为260nm;进样体积10μl。
系统适用性 要求系统适用性溶液色谱图中,氟达拉滨峰的保留时间约为3分钟,氟达拉滨峰与杂质Ⅲ峰(相对保留时间约为1.5)的分离度应不小于5.0。灵敏度溶液色谱图中,主成分色谱峰峰高的信噪比应大于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的5倍。
限度 供试品溶液色谱图中如有杂质峰,杂质Ⅲ校正后的峰面积(乘以校正因子0.5)不得大于对照溶液主峰面积的0.5倍(0.1%),相对保留时间约为1.9的杂质校正后的峰面积(乘以校正因子0.6)不得大于对照溶液的主峰面积(0.2%),相对保留时间约为2.5的杂质校正后的峰面积(乘以校正因子1.8)不得大于对照溶液的主峰面积(0.2%),其他单个未知杂质峰面积均不得大于对照溶液主峰面积的0.5倍(0.1%),供试品溶液色谱图中小于灵敏度溶液主峰面积的峰忽略不计(0.02%)。
限度(包括有关物质I和有关物质Ⅱ)供试品溶液色谱图中,各未知杂质峰面积之和不得大于对照溶液主峰面积的2.5倍(0.5%),各杂质校正后的峰面积之和不得大于对照溶液主峰面积的7.5倍(1.5%),供试品溶液色谱图中小于灵敏度溶液主峰面积的峰忽略不计(0.02%)。
残留溶剂照残留溶剂测定法(通则0861)测定,应符合规定。
水分 取本品,照水分测定法(通则0832第一法1)测定,含水分不得过3.0%。
重金属 取本品0.5g,置50ml比色管中,加水20ml和醋酸盐缓冲液(pH3.5)2ml,加热使溶解,放冷,加水至25ml,依法检查(通则0821第一法),含重金属不得过百万分之二十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含20μg的溶液。
对照品溶液 取磷酸氟达拉滨对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含20μg的溶液。
系统适用性溶液、色谱条件与系统适用性要求除灵敏度要求外,见有关物质Ⅰ项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗肿瘤药。
遮光,密封,冷处保存。
杂质Ⅰ
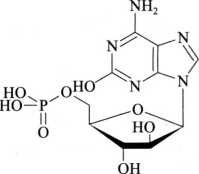
C10H14N5O8P 363.21
9-β-D·呋喃阿拉伯糖基-2-羟基腺嘌呤5'-(磷酸二氢酯)
杂质Ⅱ
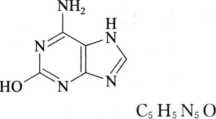 151. 13
151. 13
6-氨基-7H-嘌呤-2-醇
杂质Ⅲ
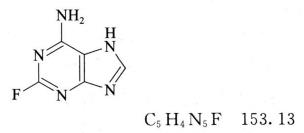
2-氟-7H-嘌呤-6-胺
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
