登录/
注册
登录/
注册
依托度酸
Yituodusuan
Etodolac
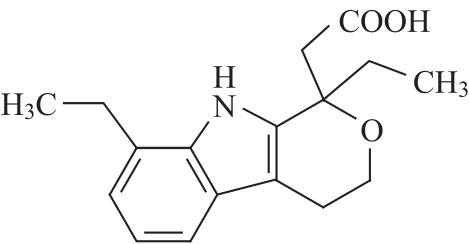
C17H21NO3 287.36
本品为(±)1,8-二乙基-1,3,4,9-四氢吡喃并[3,4-b]吲哚-1-乙酸。按干燥品计算,含C17H21NO3不得少于98.5%。
本品为白色或类白色结晶性粉末。
本品在乙醇中易溶,在水中几乎不溶。
熔点本品的熔点(通则0612)为144~150℃。
①镇痛、解热:本品可迅速而有效地缓解以下急性疼痛,如痛风性关节炎、肩痛、下背痛、运动性软组织损伤、腱鞘炎、滑囊炎、痛经、拔牙后及手术后疼痛等。也可用于发热疾病的退热。本品仅能缓解症状,对疼痛和发热的病因治疗还需采用其他措施。②抗炎、抗风湿:本品广泛用于治疗骨关节炎、类风湿关节炎、强直性脊柱炎,其他脊柱关节病和反应性关节炎等以及关节周围的软组织风湿症(如网球肘、肩周炎、腰痛症、颈肩腕综合征和纤维肌痛等),可减轻缓解病变部位的疼痛、肿胀、发僵及活动受限,并可使血沉和C-反应蛋白水平下降。
口服成人(1)解热、镇痛普通片,一次0.2~0.4g,一日2次;缓释片,一次0.4~0.8g,一日1次,必要时12小时后重复1次。
(2)治疗关节炎缓释片,一次400~800mg,一日1次,但应根据每例患者病情和临床疗效增减剂量。
(1)药效学 ①镇痛作用:主要通过抑制前列腺素及其他使痛阈降低的物质(如组胺和缓激肽等)的合成而发挥镇痛作用。其镇痛活性与其他非甾体抗炎药和可待因相当,但有优于阿司匹林的实验资料。②抗炎作用:实验资料提示,本品可通过阻断炎症部位前列腺素合成,降低巨噬细胞迁移性及抑制白介素-1和白介素-6而起抗炎作用,但对生理情况下胃黏膜和肾脏产生的前列腺素无明显影响。③解热作用:本品解热作用可能与抑制前列腺素的萘普生的剂量相同。④抗风湿作用:实验证实本品对鼠实验性关节炎的软组织肿胀、关节间隙狭窄及骨膜反应均有明显抑制作用,并对已有破坏的骨关节病变有减缓或阻止发展的作用。其作用机制或许可参考以下资料:如有报告,本品可显著降低骨关节炎患者滑液中前列腺素和白介素-6水平,另外,本品对关节软骨细胞代谢及基质蛋白聚糖合成无不良影响,此特点是阿司匹林和吲哚美辛所不及的。
(2)药动学 口服后吸收良好,大约1.2小时达到峰值水平(平均Cmax=15.9μg/ml),缓释片则延长至大约7小时。本品在30分钟内产生镇痛作用,多剂量不产生显著蓄积作用。平均清除t1/2约为7.3小时,缓释片t1/2约为8.3小时。每天多次用药不改变清除半衰期。本品吸收过程存在肠-肝循环,药-时曲线出现双峰。本品在肝脏几乎完全代谢,大约73%经尿排泄,少数由胆汁排出。本品用于特殊人群,如老年患者,轻度肾损伤或肝病稳定期患者,无须调整剂量。
(1)消化道反应表现有消化不良、恶心、上腹部灼热感、腹痛及腹泻,发生率在1.0%~14.3%;胃肠道溃疡的发生率为0.06%。
(2)过敏反应皮疹在<1.0%~2.6%之间。
(3)神经和精神头痛、头晕和嗜睡在<1.0%~2.8%之间。
(4)其他肝、肾和血液系统不良反应发生率均小于1.0%。
(1)对本品、阿司匹林以及其他NSAIDs过敏者。
(2)美国FDA妊娠期药物安全性分级为口服给药C;如在妊娠晚期或临近分娩时用药D。
(3)哺乳期妇女禁用。
(4)活动性消化性溃疡或胃肠出血的患者。
(1)长期服用本品,可能出现胃肠出血、溃疡或穿孔,尤其在年老或体弱者,故应在医师指导下用药并注意随访观察。
(2)有心肌梗死及脑卒中者慎用或者避免连续服药时间过长。
(3)如同其他NSAIDs,对肾、肝功能损害,心功能不全,老年多病者,应谨慎用本品并密切观察。如有不良反应,应即停用。
(4)本品可能使肝酶升高,引起贫血,出现液体潴留和肢体水肿。因此,对长期用本品治疗的患者应定期检查血、尿常规和肝肾功能。高血压或心衰患者应慎用。
(5)过量用药的处理没有特效的解毒药,用对症和支持疗法处理过量患者,包括对摄入大剂量(常用剂量的5~10倍)或摄入后4小时内有症状者给予洗胃,同时使用催吐剂和(或)活性炭(成人剂量60~100g,儿童1~2g/kg)以及渗透性导泻治疗。因本品的蛋白结合率很高,其他如利尿、碱化尿液或血液透析疗法等对排出本品可能无。
(1)不建议本品与阿司匹林或其他NSAIDs同时用,以免增加不良事件的发生。
(2)本品和抗酸药同时服用不会影响本品的吸收程度,达峰时间也不出现可测出的影响,但可使血药峰浓度降低15%~20%。
(3)有数例报道,用本品治疗的患者同时接受华法林治疗可使华法林蛋白结合率下降,使患者的凝血酶原时间延长(不论是否伴发出血),故应慎用并应加强观察。
(4)保泰松可使依托度酸的游离部分增加约80%,因此不主张这两种药物同时使用。
(5)本品可能引起环孢素、地高辛、锂剂和甲氨蝶呤血药浓度升高,建议本品不与后几种药物并用。
依托度酸片:(1)200mg;(2)400mg。
依托度酸缓释片:400mg。
依托度酸胶囊:0.2g。
(1)照薄层色谱法(通则0502)试验。
供试品溶液 取本品适量,加丙酮溶解并稀释制成每1ml中约含1mg的溶液。
对照品溶液 取依托度酸对照品适量,加丙酮溶解并稀释制成每1ml中约含1mg的溶液。
色谱条件采用硅胶GF254薄层板上,以甲苯-无水乙醇-冰醋酸(70∶30∶0.5)为展开剂。
测定法 吸取供试品溶液与对照品溶液各5μl,分别点于同一薄层板上,展开,取出,晾干,置紫外光灯(254nm)下检视。
结果 判定供试品溶液所显主斑点的位置和颜色应与对照品溶液的主斑点一致。
(2)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,加乙腈溶解并稀释制成每1ml中约含0.5mg的溶液。
对照溶液 精密量取供试品溶液适量,用乙腈定量稀释制成每1ml中约含1μg的溶液。
系统适用性溶液 取依托度酸对照品与杂质I对照品各适量,加乙腈溶解并稀释制成每1ml中含依托度酸约0.5mg与杂质I约10μg的混合溶液。
色谱条件 用辛基硅烷键合硅胶为填充剂;以0.6%(V/V)磷酸溶液为流动相A,0.6%(V/V)磷酸乙腈溶液为流动相B;按下表进行梯度洗脱;检测波长为225nm;进样体积20μl。
时间(分钟) 流动相A(%) 流动相B(%)
0 60 40
5 60 40
35 20 80
35.1 60 40
45 60 40
系统适用性要求系统适用性溶液色谱图中,杂质I峰与依托度酸峰间的分离度应大于6.0。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中如有杂质峰,杂质I与杂质II(杂质I与杂质II保留时间相同)峰面积的和不得大于对照溶液主峰面积的2.5倍(0.5%),其他单个杂质峰面积不得大于对照溶液主峰面积(0.2%),各杂质峰面积的和不得大于对照溶液主峰面积的5倍(1.0%)。
残留溶剂照残留溶剂测定法(通则0861第二法)测定。
供试品溶液 取本品约0.1g,精密称定,置顶空瓶中,精密加入N,N-二甲基甲酰胺2ml使溶解,密封。
对照品溶液 取甲醇和甲苯各适量,精密称定,用N,N-二甲基甲酰胺定量稀释制成每1ml中含甲醇0.15mg和甲苯0.0445mg的混合溶液,精密量取2ml,置顶空瓶中,密封。
色谱条件 以6%氰丙基苯基-94%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱;起始温度40℃,维持5分钟,再以每分钟35℃的速率升温至220℃,维持2分钟;进样口温度为200℃,检测器温度为260℃;顶空瓶平衡温度为80℃,平衡时间为30分钟。
系统适用性 要求对照品溶液色谱图中,甲醇峰与甲苯峰间的分离度应符合要求。
测定法 精密量取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,甲醇和甲苯的残留量均应符合规定。
氯化物 取本品0.20g,加甲醇34ml,振摇使溶解,加水6ml,依法检查(通则0801),与标准氯化钠溶液6.0ml,加甲醇34ml制成的对照液比较,不得更浓(0.03%)。
干燥失重 取本品,以五氧化二磷为干燥剂,在60℃减压干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
取本品约0.5g,精密称定,加中性乙醇(对酚酞指示液显中性)30ml,溶解后,加酚酞指示液数滴,用氢氧化钠滴定液(0.1mol/L)滴定。每1ml的氢氧化钠滴定液(0.1mol/L)相当于28.74mg的C17H21NO3。
解热镇痛、非甾体抗炎药。
密封,干燥处保存。
杂质Ⅰ(1-甲基依托度酸)
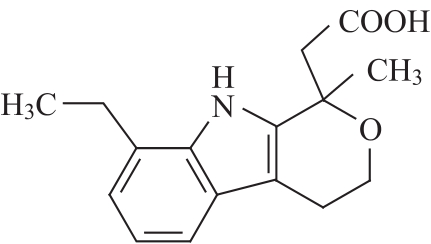
C16H19NO3 273.4
(±)8-乙基-1-甲基-1,3,4,9-四氢吡喃并[3,4-b]吲哚-1-乙酸
杂质Ⅱ(8-甲基依托度酸)
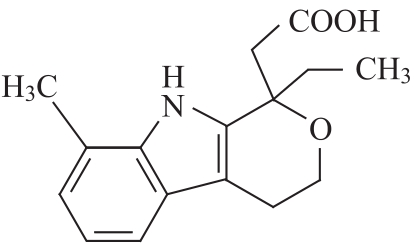
C16H19NO3 273.4
(+)1-乙基-8-甲基-1,3,4,9-四氢吡喃并[3,4-b]吲哚-1-乙酸
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
