登录/
注册
登录/
注册
沙利度胺
Shalidu‘an
Thalidomide
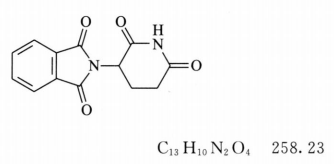
本品为(±)-N-(2,6-二氧代-3-哌啶基)-邻苯二甲酰亚胺。按干燥品计算,含C13H10N2O4应为98.0%~102.0%。
为一种镇静剂,对于各型麻风反应如发热、结节红斑、神经痛、关节痛、淋巴结肿大等,有一定疗效,对结核样的麻风反应疗效稍差。对麻风本病无治疗作用,可与抗麻风药同用以减少反应。
近年来国内外尝试用沙利度胺治疗移植物抗宿主病、克罗恩病、难治性多发性骨髓瘤、白血病、强直性脊柱炎、类风湿关节炎、系统性红斑狼疮、白塞病、硬皮病及成人斯蒂尔病等,并取得了较好的临床疗效。
口服成人常用量由小剂量开始,一日25mg,睡前服用,无不良反应可逐渐增加剂量,具体剂量根据病情调整,一日可达300mg。
(1)药效学 抑制血管新生和免疫调节。体外试验证实沙利度胺可通过抑制和下调βFGF、VEGF、VCAM-A和E-selectin等促进血管生长的细胞因子来发挥其抗血管新生作用。具有免疫调节作用。可影响白细胞、内皮细胞及角质形成细胞等,可改变黏附分子的浓度进而影响炎症组织的白细胞外渗以及抑制炎症反应。通过对单核细胞因子的抑制和对T淋巴细胞活化的共刺激效应的正负协调来发挥作用。抗炎作用最基本的机制是通过作用于单核细胞来抑制TNF-α的释放,并促进TNF-αmRNA降解,从而抑制细胞因子TNF-α在单核细胞和巨噬细胞的生成。本药对麻风病并无治疗作用,可与麻风药合用以减少反应。
(2)药动学 临床所用沙利度胺通常为消旋混合物。该药口服吸收效果好,血药浓度峰值时间为2小时。血浆蛋白结合量较低。口服后无明显的肝脏代谢,主要的清除途径是非酶的水解作用,清除半衰期为5~7小时。在分解过程中酶代谢与肾排泄参与很少,因此药物相互作用的危险性并不大。其药物分布及代谢的个体差异甚微。
(1)有强的致畸作用,妊娠早期服用可致胎儿畸形,成为短肢的海豹儿。
(2)胃肠道不适,口干、口苦、便秘、食欲减退;头昏、倦怠;严重者须停药并给予对症治疗。偶有过敏而发生药疹。
(3)可引起多发性神经炎,表现为手脚麻木,肌肉紧缩及下肢无力感。
本品有严重的致畸作用。如果在怀孕期间服用本品,对未出生的胎儿会引起严重的出生缺陷和死亡。妊娠期妇女禁用。对本品过敏者禁用。
(1)对于育龄妇女,有效的避孕措施要开始于服药前的至少4周,第1个月应每周做怀孕测试,测试阴性方可继续服药,此后,如果患者月经周期规律,可1个月做1次怀孕测试,不规律则要每2周检查1次。患者停药至少4周后方许怀孕。服药期间不允许母乳喂养。
(2)男性患者服药期间性生活时最好使用避孕套,服药期间不允许献血。
(3)用于心血管疾病高发患者时,注意患者心衰及血栓形成情况。若患者同时服用β受体拮抗药,则更要注意。必要时停药及对症治疗。
(4)用药期间定期检查血象,中性粒细胞的绝对值低于0.75×109/L的患者不要服用。
能增强其他中枢抑制剂,尤其是巴比妥类药的作用。
沙利度胺片:(1)25mg;(2)50mg。
沙利度胺胶囊:25mg。
(1)取本品约0.1g,置试管中,加氢氧化钠试液10ml,加热至沸,即产生氨的臭气,放冷,加茚三酮10mg,茚三酮周围显蓝色。
(2)本品的红外光吸收图谱应与对照品的图谱一致(通则0402)。
有关物质照高效液相色谱法(通则0512)测定。
溶剂乙腈-水-磷酸(50∶50∶0.1)。
供试品溶液 取本品约0.1g,精密称定,置50ml量瓶中,加溶剂适量,超声使溶解并稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加磷酸溶液(1→100)10ml,用水稀释至刻度,摇匀。
对照品溶液 取沙利度胺对照品适量,加乙腈溶解并稀释制成每1ml中含1mg的溶液,作为溶液(1);另取邻苯二甲酸对照品适量,精密称定,用乙腈-水(80∶5)溶解并定量稀释制成每1ml中含1mg的溶液,精密量取适量,用乙腈定量稀释制成每1ml中含0.1mg的溶液,作为溶液(2);精密量取溶液(1)、(2)各2ml,置同一100ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加磷酸溶液(1→100)10ml,用水稀释至刻度,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(3.9mm×150mm,4μm或效能相当的色谱柱);以乙腈-水-磷酸(5∶95∶0.1)为流动相A,乙腈-水-磷酸(15∶85∶0.1)为流动相B,流速为每分钟2ml,按下表进行梯度洗脱;检测波长为218nm;进样体积200μl。
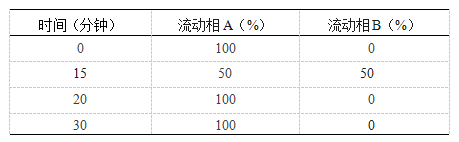
系统适用性 要求对照品溶液色谱图中,调节流速使沙利度胺峰的保留时间约为14分钟;邻苯二甲酸峰与沙利度胺峰的相对保留时间约为0.3。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。
限度供试品溶液的色谱图中如有杂质峰,按外标法以邻苯二甲酸峰面积计算,单个杂质不得过0.1%,杂质总量不得过0.3%。
残留溶剂照残留溶剂测定法(通则0861第三法)测定。
供试品溶液 取本品0.1g,精密称定,置10ml量瓶中,加二甲基亚砜溶解并稀释至刻度,摇匀。
对照品溶液 取N,N-二甲基甲酰胺适量,精密称定,用二甲基亚砜定量稀释制成每1ml中含8.0μg的溶液。
色谱条件 以聚乙二醇(PEG-20MX或极性相近)为固定液;起始温度为50℃,维持3分钟,以每分钟20℃的速率升温至200℃,维持7分钟;进样口温度为250℃;检测器温度为280℃;进样体积1μl。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度按外标法以峰面积计算,N,N-二甲基甲酰胺的残留量应符合规定。
干燥失重 取本品,在105℃干燥4小时,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.3%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821),含重金属不得过百万分之二十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品约0.1g,精密称定,置100ml量瓶中,加乙腈80ml,超声使溶解,放冷,用乙腈稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加磷酸溶液(1→100)10ml,用水稀释至刻度,摇匀。
对照品溶液 取沙利度胺对照品约0.1g,精密称定,置100ml量瓶中,加乙腈80ml,超声使溶解,放冷,用乙腈稀释至刻度,摇匀,精密量取10ml,置100ml量瓶中,加磷酸溶液(1→100)10ml,用水稀释至刻度,摇匀。
色谱条件用十八烷基硅烷键合硅胶为填充剂;以乙腈-水-磷酸(15∶85∶0.1)为流动相;检测波长为237nm;进样体积20μl。
系统适用性 要求理论板数按沙利度胺峰计算不低于7000。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
免疫调节药。
密封保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
