登录/
注册
登录/
注册
肝素钠
Gansuna
Heparin Sodium
本品系自猪肠黏膜中提取的硫酸氨基葡聚糖的钠盐,是由不同分子量的糖链组成的混合物,由α-D-氨基葡萄糖(N-硫酸化,O-硫酸化或N-乙酰化)和O-硫酸化糖醛酸(ɑ-L-艾杜糖醛酸或β-D葡萄糖醛酸)交替连接形成聚合物,具有延长血凝时间的作用。按干燥品计算,本品每1mg抗Ⅱa因子的效价不得少于180IU,抗Xa因子效价与抗Ⅱa因子的效价比应为0.9~1.1。
本品应从检疫合格的猪肠黏膜中提取,并对肝素的动物来源进行种属鉴别,生产过程应符合现行版《药品生产质量管理规范》要求。生产工艺应经病毒灭活验证,并能有效去除有害的污染物。
本品为白色或类白色的粉末;极具引湿性。
本品在水中易溶。
比旋度 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含40mg的溶液,依法测定(通则0621),比旋度应不小于+50°。
(1)用于防治血栓形成或栓塞性疾病:①近期发生的深静脉血栓形成,应用肝素预防血栓形成和扩展,减少肺动脉栓塞的发生率。②肺动脉栓塞。③不稳定型心绞痛和非ST段抬高型心肌梗死急性期的治疗。④急性ST段抬高型心肌梗死时,减少血栓栓塞并发症。⑤防止导管检查及介入治疗时血栓栓塞。⑥预防血栓形成。对有“栓塞高危因素”(包括有血栓栓塞史、术后长期卧床及年龄超过40岁等)患者进行腹部、骨科和胸腔大手术后以及有选择性、无出血危险的长期卧床患者预防深静脉血栓形成及肺栓塞,预防具有栓塞危险因素的心房颤动患者心脏复律或手术前及术中发生体循环血栓栓塞。⑦减少脑卒中患者脑血栓形成的危险并降低其死亡率。
(2)弥散性血管内凝血。
(3)体外循环、血液透析或腹膜透析时预防血液凝固。
(4)用作输血及血样标本体外实验的抗凝药。
(5)其他 近年发现肝素有清除血脂作用,因其能促进脂蛋白酯酶(清除因子)从组织释放,后者催化三酰甘油水解,并能增强抗凝血酶Ⅲ对血管舒缓素的抑制作用,因而可抑制遗传性血管神经性水肿的急性发作。
成人 ①深部皮下注射 首次 5000~10000U,以后每8 小时 8000~10000 U或每 12 小时15000~20000 U;每24小时总量 30000~40000 U,应根据凝血试验监测结果调整剂量。②静脉注射 首次 5000~1000U,之后按体重每4小时给予100 U/kg,用氯化钠注射液稀释后应用,应按 APTT测定结果调整用量。③静脉滴注 每日20000~40000 U,加至氯化钠注射液中持续滴注。静脉滴注前可先静脉注射 5000U作为初始剂量,静脉滴注过程中按 APTT 测定结果调整用量。④预防性治疗 高危血栓形成患者,大多是用于手术之后,以防止深静脉血栓形成。在外科手术前2小时先给予5000U肝素皮下注射,然后每隔 8~12 小时给予5000 U,共约7日。
【儿科用法与用量】 静脉滴注 一次100 U/kg或lmg/kg,溶解于10%葡萄糖注射液或0.9%氯化钠注射液 50~100 ml中,在4小时内缓慢滴人。
【儿科注意事项】毒性较低,用药过多可致自发性出血。
(1)药效学 肝素影响凝血过程的许多环节∶①抑制凝血酶原激酶形成,肝素与抗凝血酶Ⅲ(AT-Ⅲ)结合,形成肝素-AT-Ⅲ复合物,从而大大增强AT-Ⅲ的效能。AT-Ⅲ是一种丝氨酸蛋白酶抑制药,可灭活具有丝氨酸蛋白酶活性的凝血因子,如因子Ⅶa、Xa、Ⅸa 和Xa等,故肝素通过结合AT-Ⅲ形成复合物加速其对凝血因子的灭活作用,抑制凝血酶原激酶的形成,并能对抗已形成的凝血酶原激酶的作用。②干扰凝血酶,小剂量肝素与AT-Ⅲ结合后使AT-Ⅲ的反应部位(精氨酸残基)更易与凝血酶的活性中心(丝氨酸残基)结合成稳定的凝血酶-抗凝血酶复合物,从而灭活凝血酶,抑制纤维蛋白原转变为纤维蛋白。③干扰凝血酶对因子XⅢ的激活,影响非溶性纤维蛋白的形成;阻止凝血酶对因子Ⅷ和V的正常激活。④阻抑血小板的黏附和聚集,从而防止血小板崩解而释放血小板第Ⅲ因子及 5-羟色胺。肝素可延长活化部分凝血活酶时间(APTT或 KPTT)、凝血酶原时间、全血凝固时间或激活凝血时间(ACT)。肝素的抗凝作用与其分子中具有强阴电荷的硫酸根有关,当硫酸基团被水解或被带有强阳电荷的鱼精蛋白中和后,迅即失去抗凝活力。
(2)药动学 口服不吸收,皮下、肌内或静脉注射,吸收良好。分布于血细胞和血浆中,部分可弥散到血管外组织间隙。由于分子较大,不能通过胸膜和腹膜,也不能通过胎盘组织或泌人乳汁。本品起效时间与给药方式有关。直接静脉注射即刻发挥最大抗凝效应,以后作用逐渐下降,3~4小时后血凝恢复正常。静脉滴注起效时间取决于滴注速度。皮下注射起效一般在 20~60 分钟内,存在个体差异。静脉滴注后能与血浆低密度脂蛋白高度结合.形成复合物,也结合于球蛋白及纤维蛋白原,由单核巨噬细胞系统摄取,经肝内肝素酶作用,部分分解为尿肝素(uroheparin)。肝素还能与血小板因子Ⅳ及高分子量 von Willebrand 因子结合。静脉滴注后,t1/2为1~6小时,平均为1.5小时,与用量相关,按体重静脉注射100 U/kg、200 U/kg 或 400 U/kg,t1/2分别为56分钟、96分钟、152分钟。慢性肝、肾功能不全及过度肥胖者,肝素代谢、排泄延迟,有体内潴留可能。代谢产物尿肝素,经肾排泄,大量静脉注射给药后则 50%以原形排出。血浆内肝素浓度不受透析的影响。
(1)本品毒性较低,自发性出血倾向是肝素过量使用的最主要危险。
(2)本品偶可发生过敏反应,表现为发热、皮疹、瘙痒、鼻炎、结膜炎、哮喘、心前区紧迫感及呼吸短促。
(3)肌内注射可引起局部血肿。
(4)偶见一过性脱发和腹泻。
(5)长期使用可引起骨质疏松和自发性骨折。
(6)长期使用有时反可致血栓形成,可能是抗凝血酶Ⅲ耗竭的后果。
(7)血小板减少症 有两种类型,一种为轻型(Ⅰ型),血小板计数常呈中度降低,不出现血栓或出血症状,一般发生在用药后 2~4日,即使继续应用肝素,血小板也常可自行恢复;另一种为重症(Ⅱ型),由于体内产生了肝素依赖性抗血小板抗体,血小板大量聚集而致循环血中血小板显著减少,一般发生于用药后 2~8日,可由于血栓栓塞而导致皮肤、肢体或脏器坏死。
(1)不能控制的活动性出血患者禁用。
(2)有出血性疾病的患者禁用,包括血友病、血小板减少性或血管性紫癫。
(3)外伤或术后渗血者禁用。
(4)先兆流产者禁用。
(5)感染性心内膜炎者禁用,除非有其他指征。胃、十二指肠溃疡,严重肝肾功能不全者禁用。
(6)严重未控制的高血压、颅内出血者禁用。
(7)对肝素过敏者禁用。
(8)美国FDA 妊娠期用药安全性分级为肠道外给药C。
(1)妊娠最后3个月或产后,有增加母体出血危险,尤其是在分娩时,须慎用。
(2)硬膜外麻醉时尽可能地暂停用药。
(3)60岁以上老年人,尤其是老年女性对肝素较为敏感,用药期间容易出血,应减少用量,加强监测。
(4)干扰诊断∶可延长一期法凝血酶原时间,使磺溴酞钠(BSP)试验潴留时间延长而呈假阳性反应,导致T3、T4浓度增加,从而抑制垂体促甲状腺激素的释放。用量达15000~20000U时,血清胆固醇水平下降。
(5)下列情况应慎用∶①有过敏性疾病及哮喘病史。②口腔手术等易致出血的操作。③已口服足量的抗凝药者。④月经量过多者。
(6)使用前宜测定全血凝固时间(试管法)或活化部分凝血活酶时间(APTT或 KPTT)以及一期法凝血酶原时间。治疗期间应测定全血凝固时间(试管法)或活化部分凝血活酶时间(APTT 或 KPTT),血细胞比容、粪便潜血试验、尿隐血试验及血小板计数等。
(7)当口服抗凝药替换肝素时应加强临床监测。
(8)本品对蛇咬伤所致 DIC无效。
(9)本品易致眶内及颅内出血,故眼科与神经科手术及有出血性疾病者,不宜作为预防用药。
(10)早期逾量的表现有黏膜和伤口出血、齿龈渗血、皮肤瘀斑或紫癜、鼻出血、月经量过多等。严重时有内出血征象,表现为腹痛、腹胀、背痛、麻痹性肠梗阻、咯血、呕血、血尿、血便及持续性头痛,甚至可使心脏停搏。
(11)肝素干扰凝血酶原时间的测定,必须在应用肝素4小时后重复测定。
(12)若血浆中 AT-Ⅲ降低,则肝素疗效较差,此时需输注血浆或 ATⅢ。
(13)肝素代谢迅速,轻微过量时停用即可;严重过量时应用鱼精蛋白缓慢静脉注射予以中和,通常1mg 鱼精蛋白能中和100U肝素;如果肝素注射后已超过30 分钟,鱼精蛋白用量需减半。
(1)与下列药物合用,可加重出血危险∶①香豆素及其衍生物,可导致严重的因子Ⅸ缺乏而引发出血。②阿司匹林及非甾体抗炎药,能抑制血小板功能,并诱发胃肠道溃疡出血。③双密达莫、右旋糖酐等可能抑制血小板功能,增加出血危险性。④肾上腺皮质激素,促肾上腺皮质激素等易诱发胃肠道溃疡出血。⑤其他尚有利尿酸、阿替普酶(rt-PA)、尿激酶、链激酶等。
(2)甲巯咪唑、丙硫氧嘧啶等与本品有协同作用。
肝素钠注射液∶(1)2 ml∶1000 U; (2)2ml:5000 U; (3)2 ml:125000 U。
肝素钠乳膏∶20g∶5000 U。
(1)取本品,照效价测定项下的方法测定,抗Xa因子效价与抗Ⅱa因子效价比应为0.9~1.1。
(2)取本品适量,加水溶解并稀释制成每1ml中约含10mg的溶液,作为供试品溶液。照有关物质项下的方法测定,对照品溶液(3)色谱图中,硫酸皮肤素峰高与肝素和硫酸皮肤素峰之间谷高之比不得少于1.3,供试品溶液色谱图中,供试品溶液主峰的保留时间应与对照品溶液(3)主峰的保留时间一致,保留时间相对偏差不得过5.0%。
(3)本品的水溶液显钠盐鉴别(1)的反应(通则0301)。
分子量与分子量分布 照分子排阻色谱法(通则0514)测定。
供试品溶液 取本品适量,加流动相溶解并稀释制成每1ml中约含5mg的溶液。
对照品溶液 取肝素分子量对照品适量,加流动相溶解并稀释制成每1ml中约含5mg的溶液。
系统适用性溶液 取肝素分子量系统适用性对照品适量,加流动相溶解并稀释制成每1ml中约含5mg的溶液。
色谱条件 以亲水改性键合硅胶为填充剂(TSK预柱,6mm×40mm,TSKgelG4000SWXL,7.8mm×300mm,TSKgelG3000SWXL,7.8mm×300mm,串联使用);以0.1mol/L醋酸铵溶液为流动相;流速为每分钟0.6ml;柱温为30℃;示差折光检测器;进样体积25μl。
系统适用性要求 系统适用性溶液色谱图中,主峰与溶剂峰能够彻底洗脱,重均分子量应在标示值±500范围内。
测定法 取对照品溶液,注入液相色谱仪,记录色谱图。准确计算对照品溶液色谱图中肝素峰的总面积(不包括盐峰)及每个点的累积峰面积百分比,确定与肝素分子量对照品附带的宽分布标样表中累积峰面积百分比最接近点的保留时间及对应的分子量,以保留时间为横坐标,分子量的对数值为纵坐标,使用GPC软件,拟合三次方程,建立校正曲线,相关系数应不小于0.990。
另取供试品溶液,注入液相色谱仪,记录色谱图,按下式计算本品的重均分子量。
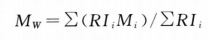
式中 RIi为洗脱的i级分的物质量,即示差色谱图的峰高;Mi为由校正曲线计算得出的i级分的分子量。
限度 重均分子量应为15 000~19 000,分子量大于24 000的级分不得大于20%,分子量8000~16 000的级分与分子量16 000~24 000的级分比应不小于1.0。
总氮量 取本品,照氮测定法(通则0704第二法)测定,按干燥品计算,本品总氮(N)含量应为1.3%~2.5%。
酸碱度 取本品0.10g,加水10ml溶解后,依法测定(通则0631),pH值应为5.0~8.0。
溶液的澄清度与颜色 取本品0.50g,加水10ml溶解后,溶液应澄清无色;如显浑浊,照紫外-可见分光光度法(通则0401),在640nm的波长处测定吸光度,不得过0.018;如显色,与黄色1号标准比色液(通则0901第一法)比较,不得更深。
核酸 取本品,精密称定,加水溶解并定量稀释制成每1ml中约含4mg的溶液,照紫外-可见分光光度法(通则0401),在260nm的波长处测定吸光度,不得过0.10。
蛋白质 照蛋白质含量测定法(通则0731第二法)测定。
供试品溶液 取本品适量,精密称定,加水溶解并定量稀释制成每1ml中约含30mg的溶液。
对照品溶液 取牛血清白蛋白对照品适量,精密称定,分别加水溶解并定量稀释制成每1ml中各约含0、10μg、20μg、30μg、40μg与50μg的溶液。
限度 按干燥品计算,含蛋白质不得过0.5%。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加水溶解并定量稀释制成每1ml中约含100mg的溶液,涡旋混合至完全溶解,精密量取0.5ml,加1mol/L盐酸溶液0.25ml与25%亚硝酸钠溶液0.05ml,振摇混匀,反应40分钟,加1mol/L氢氧化钠溶液0.2ml终止反应。
对照品溶液(1) 取肝素对照品0.25g,精密称定,精密加水2ml,涡旋混匀至完全溶解。
对照品溶液(2) 精密量取对照品溶液(1)1.2ml,加2%硫酸皮肤素对照品0.15ml与2%多硫酸软骨素对照品0.15ml。
对照品溶液(3) 取对照品溶液(2)0.1ml,用水稀释至1ml。
对照品溶液(4) 取对照品溶液(1)0.4ml,加水0.1ml,混匀,加1mol/L盐酸溶液0.25ml与25%亚硝酸钠溶液0.05ml,振摇混匀,反应40分钟,加1mol/L氢氧化钠溶液0.2ml终止反应。
对照品溶液(5) 精密量取对照品溶液(2)0.5ml,加1mol/L盐酸溶液0.25ml和25%亚硝酸钠溶液0.05ml,振摇混匀,反应40分钟,加1mol/L氢氧化钠溶液0.2ml终止反应。
色谱条件 以烷醇季铵为功能基的乙基乙烯基苯-二乙烯基苯聚合物树脂为填充剂(AS11-HC阴离子交换柱,2mm×250mm,与AG11-HC保护柱,2mm×50mm,或其他适宜的色谱柱);以0.04%磷酸二氢钠溶液(用磷酸调节pH值至3.0,0.45μm滤膜过滤,临用前脱气)为流动相A,以高氯酸钠-磷酸盐溶液(取高氯酸钠140g,用0.04%磷酸二氢钠溶液溶解并稀释至1000ml,用磷酸调节pH值至3.0,0.45μm滤膜过滤,临用前脱气)为流动相B,按下表进行线性梯度洗脱;流速为每分钟0.22ml;检测波长为202nm;进样体积20μl。
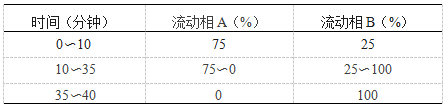
系统适用性要求 对照品溶液(4)色谱图中应不出现肝素峰,对照品溶液(5)色谱图中硫酸皮肤素与多硫酸软骨素色谱峰的分离度不得小于3.0。
测定法 精密量取供试品溶液,注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中硫酸皮肤素的峰面积不得大于对照品溶液(5)中硫酸皮肤素的峰面积(2.0%);除硫酸皮肤素峰外,不得出现其他色谱峰。
残留溶剂 照残留溶剂测定法(通则0861第二法)测定。
内标溶液 称取正丙醇适量,用水定量稀释制成每1ml中约含80μg的溶液。
供试品溶液 取本品约2.0g,精密称定,置10ml量瓶中,加内标溶液溶解并稀释至刻度,摇匀,精密量取3ml,置预先加有氯化钠0.5g的顶空瓶中,密封。
对照品溶液取甲醇、乙醇、丙酮适量,精密称定,用内标溶液定量稀释制成每1ml中约含甲醇400μg、乙醇400μg与丙酮80μg的混合溶液,精密量取3ml,置预先加有氯化钠0.5g的顶空瓶中,密封。
色谱条件 采用6%氰丙基苯基-94%二甲基聚硅氧烷(或极性相似)为固定液的毛细管柱为色谱柱;起始温度为40℃,维持4分钟,以每分钟3℃的速率升温至58℃,再以每分钟20℃的速率升温至160℃;进样口温度为160℃;检测器温度为250℃;顶空瓶平衡温度为90℃,平衡时间为20分钟。
系统适用性要求 对照品溶液色谱图中,出峰顺序依次为甲醇、乙醇、丙酮、正丙醇,相邻各色谱峰间分离度均应符合规定。
测定法 取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度 按内标法以峰面积计算,甲醇、乙醇与丙酮的残留量均应符合规定。
干燥失重 取本品,置五氧化二磷干燥器内,在60℃减压干燥至恒重,减失重量不得过5.0%(通则0831)。
炽灼残渣 取本品0.50g,依法检查(通则0841),遗留残渣应为28.0%~41.0%。
钠 照原子吸收分光光度法(通则0406第一法)测定。
盐酸溶液 0.1mol/L盐酸溶液(每1ml中含氯化铯1.27mg)。
供试品溶液 取本品约50mg,精密称定,置100ml量瓶中,加盐酸溶液溶解并稀释至刻度,摇匀。
对照品溶液 精密量取钠单元素标准溶液(每1ml中含Na200μg),用盐酸溶液分别定量稀释制成每1ml中约含钠25μg、50μg、75μg的溶液。
测定法 在330nm的波长处分别测定各对照品溶液和供试品溶液的吸光度。
限度 按干燥品计算,含钠(Na)应为10.5%~13.5%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之三十。
细菌内毒素 取本品,依法检查(通则1143),每1单位肝素中含内毒素的量应小于0.010EU。
密封,在干燥处保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
