登录/
注册
登录/
注册
盐酸多沙普仑
YansuanDuoshapulun
DoxapramHydrochloride
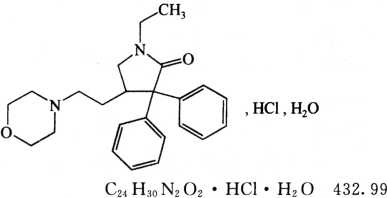
本品为(±)-1-乙基-3,3-二苯基-4-(2-吗啉乙基)-2-吡咯烷酮盐酸盐一水合物。按干燥品计算,含C24H30N2O2·HCl应为98.0%~100.5%。
本品为白色或类白色结晶性粉末;无臭。
本品在水、三氯甲烷或乙醇中略溶,在乙醚中不溶。
熔点本品的熔点(通则0612)为217~221℃。
①全身麻醉药所引起的呼吸抑制或暂停,其中肌松药的因素已除外,或自发呼吸虽存在但每分钟通气量不足;②药物逾量时所引起的轻度或中等度中枢神经抑制;③作为给氧后动脉血氧分压低的应急措施,应于2小时内解除诱因,不得迟延。
静脉注射成人(1)术后催醒0.5~1mg/kg,如需要,至少相隔5分钟后才能重复一次,总量不得超过2mg/kg。如需静脉滴注,用5%葡萄糖注射液或氯化钠注射液稀释至1mg/ml,静脉滴注开始5mg/min,获效后减至1~3mg/min,总用量最多4mg/kg。
(2)中枢抑制催醒1~2mg/kg,隔5分钟后按需可重复一次。维持量每1~2小时1~2mg/kg,直至获得效应,一日总量以3g为限。
(1)药效学 呼吸兴奋药,作用比尼可刹米强。小量时通过刺激颈动脉窦化学感受器,反射地兴奋呼吸中枢而生效;大量时才直接兴奋延脑呼吸中枢,使潮气量加大,呼吸频率增快有限。大剂量兴奋脊髓及脑干,但对大脑皮质似无影响,在阻塞性肺疾病患者发生急性通气不全时,应用此药后,潮气量、血二氧化碳分压、氧饱和度均有改善。静脉注射后20~40秒钟起效,1~2分钟效应最显著,作用仅持续5~12分钟。
(2)药动学 静脉注射后迅速分布到组织,在肝脏代谢,代谢产物及少量原形药物主要由随胆汁经粪便排泄,也可从尿排泄。
(1)常见的不良反应瘙痒、脸红、恶心、呕吐、腹泻。
(2)严重的不良反应胸痛、心律失常、溶血、呼吸困难、喘鸣、血栓性静脉炎。
(3)下列情况持续存在时应加注意:①精神错乱;②呛咳;③腹泻;④眩晕、畏光;⑤感觉奇热;⑥头痛;⑦恶心、呕吐等。
(4)逾量时征象①惊厥;②震颜;③反射亢进。
(1)对本品过敏者。
(2)严重高血压患者。
(3)颅脑损伤或脑血管意外患者。
(4)癫痫或惊厥性疾患者。
(5)心血管疾患者。
(6)机械通气障碍,如由于气道堵塞、胸廓塌陷、呼吸肌轻瘫、气胸等引起的呼吸功能不全患者。
(1)下列情况慎用①有急性支气管哮喘发作或发作史、肺栓塞、神经肌肉功能失常的呼吸衰竭、矽肺或肺纤维化呼吸受限等所致肺病变;②使用拟交感神经药或单胺氧化酶抑制药;③心动过速;④心律失常;⑤脑水肿;⑥甲状腺功能亢进或嗜铬细胞瘤等代谢亢进状态。
(2)用药期间应注意①常规测血压、腱反射和脉搏,以防止用药逾量;②于给药前和给药后半小时测定动脉血气,及早发现气道堵塞以及高碳酸血症的患者,是否有二氧化碳蓄积或呼吸性酸中毒;③通气过度可降低PCO₂,导致脑血管收缩,降低脑血管循环。④如突然出现低血压或呼吸困难,应即停药。
(3)哺乳期妇女使用本品对乳儿可能有危害。
(4)与卟啉病急性发作有相关性,因此认为用于卟啉病患者不安全。
(5)美国FDA妊娠期药物安全性分级为肠道外给药B。
(1)本药能促使儿茶酚胺的释放增多,在吸入全麻情况下,心肌对儿茶酚胺异常敏感;与全麻药如氟烷、异氟烷、恩氟烷等同时应用,可能发生心律失常,因此这些全麻药至少停用10分钟后,才能使用本品。
(2)咖啡因、哌甲酯、匹莫林、肾上腺素受体激动药等都有或大或小的中枢兴奋作用,使用时应仔细观察紧张、激动、失眠甚至惊厥或(和)心律失常。
(3)单胺氧化酶抑制药(如丙卡巴肼)或拟交感药与本药并用,它们的升压作用相加,血压比任何一药独用时升得更高。
(4)术后肌松药的残余效应,可暂时使本药的中枢兴奋作用隐而不显。
盐酸多沙普仑注射液:5ml:100mg。
(1)取本品,加水溶解并制成每1ml中约含0.4mg的溶液,照紫外-可见分光光度法(通则0401)测定,在252nm、258nm与264nm的波长处有最大吸收,在244nm、254nm与262nm的波长处有最小吸收。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集643图)一致。
(3)本品显氯化物的鉴别反应(通则0301)。
酸度 取本品0.50g,加水50ml溶解后,依法测定(通则0631),pH值应为3.5~5.0。
溶液的澄清度与颜色 取本品1.0g,加水50ml溶解后,溶液应澄清无色。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,加水溶解并稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液适量,用水定量稀释制成每1ml中约含2μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂(封端柱);以0.01mol/L醋酸钠溶液(用冰醋酸调节pH值至4.5)-乙腈(70∶30)为流动相;检测波长为214nm;进样体积10μl。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。
限度 供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积(0.2%),各杂质峰面积的和不得大于对照溶液主峰面积的5倍(1.0%)。
干燥失重 取本品,在105℃干燥2小时,减失重量应为3.0%~4.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.3%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
砷盐 取本品1.0g,加盐酸5ml与水23ml使溶解,依法检查(通则0822第一法),应符合规定(0.0002%)。
取本品约0.3g,精密称定,加冰醋酸20ml与醋酐20ml溶解后,照电位滴定法(通则0701),用高氯酸滴定液(0.1mol/L)滴定,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于41.50mg的C24H30N2O2·HCl。
中枢兴奋药。
遮光,密封保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
