登录/
注册
登录/
注册
尼莫地平
Nimodiping
Nimodipine
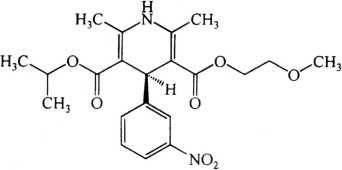
C21H26N2O7 418.45
本品为2,6-二甲基-4-(3-硝基苯基)-1,4-二氢-3,5-吡啶二甲酸2-甲氧乙酯异丙酯。按干燥品计算,含C21H26N2O7应为98.5%~101.5%。
本品为淡黄色结晶性粉末或粉末;无臭。遇光不稳定。
本品在丙酮、三氯甲烷或乙酸乙酯中易溶,在乙醇中溶解,在乙醚中微溶,在水中几乎不溶。
熔点本品的熔点(通则0612)为124~128℃。
预防和治疗各种原因的蛛网膜下隙出血后的脑血管痉挛和急性脑血管病恢复期的血液循环改善。
(1)蛛网膜下隙出血,预防性给药应在发病后96小时内开始,在血管痉挛最大危险期连续给药(持续到出血后10~14日)。①静脉滴注体重低于70kg(或血压不稳定)者,开始2小时可按每小时7.5μg/kg给药;如耐受性好,2小时后剂量可增至每小时15μg/kg。体重大于70kg者,开始2小时宜按每小时15μg/kg给药;如耐受性好,2小时后剂量可增至每小时30ag/kg。②口服一次60mg,每4小时1次,一日6次。缓释制剂:一次60~120mg,一日2次。服药后可有皮肤痒、胃食欲缺乏、血压低等不良反应,若患者发生不良反应,应减少剂量或停止给药。
(2)急性脑血管病恢复期口服一次30~60mg,一日3次。缺血性脑卒中患者原则上不采纳静脉滴注尼莫地平。
(1)药效学 为钙通道阻滞药,能有效地阻止Ca2+进入血管平滑肌细胞,松弛血管平滑肌,从而解除血管痉挛。动物实验证明,尼莫地平对脑动脉的松弛作用远较其他部位动脉的作用强,由于它脂溶性高,易透过血-脑屏障。用于蛛网膜下隙出血时,脑脊液中药物浓度可达12.5ng/ml。
(2)药动学 口服吸收快,达峰时间(tmax)为1小时,有明显首关代谢,生物利用度(F)仅为13%。当每日口服4次,连续7日后血中没有明显蓄积。血浆蛋白结合率超过95%,结合浓度分别在10ng/ml~10μg/ml之间。口服后大部分以代谢产物的形式从尿中排出,不到1%为原形药物。终末消除半衰期(t1/2β)为9小时,但最初血浓度下降很快,半衰期(t1/2)约1~2小时。缓释制剂口服后达峰时间(tmax)为3~4小时,半衰期约3~5小时。慢性肝功能损害患者中尼莫地平的生物利用度增加,其峰浓度(Cmax)可达正常人的2倍。
蛛网膜下隙出血者应用尼莫地平治疗时约有11.2%的患者出现不良反应。
(1)最常见不良反应①血压下降,血压下降的程度与药物剂量有关;②肝炎;③皮肤刺痛;④腹泻、胃绞痛、胃肠道出血;⑤血小板减少;⑥恶心、呕吐;⑦个别患者可发生ALP、LDH、AKP、血糖升高,以及血小板数升高。
(2)严重的不良反应心力衰竭、心律失常(罕见)。
美国FDA妊娠期药物安全性分级为口服给药、肠道外给药C。
(1)静脉注射或口服均可引起血压降低。蛛网膜下隙出血患者使用本品,可增加低血压的风险。在高血压合并蛛网膜下隙出血或脑梗死患者中,应注意减少或暂时停用降血压药物,或减少尼莫地平的用药剂量。
(2)静脉滴注或口服均可产生假性肠梗阻,表现为腹胀、肠鸣音减弱。当出现上述症状时应当减少用药剂量和保持观察。
(3)肝功能损害者尼莫地平的代谢下降,应当慎用。
(4)哺乳期妇女使用对乳儿的危害不能排除。
(5)儿科患者使用的安全性和有效性未建立。
(1)高血压患者应用尼莫地平可起到降压作用,可增强其他药物(如抗高血压药、抗精神病药等)的降压作用。
(2)与其他钙通道阻滞药联合用时可增加钙离子阻滞作用。
(3)当尼莫地平90mg/d与西咪替丁1000mg/d合用1周以上者,尼莫地平血浓度可增加50%,与西咪替丁抑制肝药酶有关。
(4)与胺碘酮合用,由于两者的代谢均通过CYP3A4进行,钙通道阻滞药的活性因代谢被抑制而增加,出现心动过缓和房室传导阻滞的风险增加。
(5)与芬太尼合用,可出现严重的低血压。
尼莫地平片(胶囊):(1)20mg:(2)30mg。
尼莫地平缓释片(胶囊);60mg。
尼莫地平软胶囊:20mg。
尼莫地产分散片:20mg。
尼莫地平注射液:(1)10ml:2mg;(2)20ml:4mg;(3)40ml:8mg;(4)50ml:10mg;(5)100ml:20mg。
(1)取本品约20mg,加乙醇2ml溶解后,加新制的5%硫酸亚铁铵溶液2ml,1.5mol/L硫酸溶液1滴与0.5mol/L氢氧化钾溶液1ml,强烈振摇,1分钟内沉淀由灰绿色变为红棕色。
(2)取本品适量,加乙醇制成每1ml含10μg的溶液,照紫外-可见分光光度法(通则0401)测定,在237nm的波长处有最大吸收。
(3)本品的红外光吸收图谱与对照的图谱(光谱集599图)一致。
旋光度 取本品,加丙酮溶解并定量稀释制成每1ml中含50mg的溶液,依法测定(通则0621),旋光度为-0.10°至+0.10°。
有关物质照高效液相色谱法(通则0512)测定。避光操作。
供试品溶液 取本品,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.2mg的溶液。
对照溶液 取杂质I对照品,精密称定,加流动相溶解并定量稀释制成每1ml中约含20μg的溶液,精密量取1ml,置100ml量瓶中,精密加入供试品溶液1ml,用流动相稀释至刻度,摇匀。
系统适用性溶液 取尼莫地平与杂质I对照品各适量,加流动相溶解并稀释制成每1ml中各约含200μg与1μg的混合溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以甲醇-乙腈-水(35:38:27)为流动相;检测波长为235nm;进样体积20μl。
系统适用性 要求系统适用性溶液色谱图中,尼莫地平峰与杂质I峰的分离度应大于3.0。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度 供试品溶液色谱图中如有与杂质I峰保留时间一致的色谱峰,按外标法以峰面积计算,不得过0.1%;其他单个杂质峰面积不得大于对照溶液中尼莫地平峰面积的0.5倍(0.5%),各杂质峰面积(杂质I峰面积乘以1.78)的和不得大于对照溶液中尼莫地平峰面积(1.0%),小于对照溶液中尼莫地平峰面积0.02倍的色谱峰忽略不计。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
取本品约0.18g,精密称定,加无水乙醇25ml,微温使溶解,加高氯酸溶液(取70%高氯酸溶液8.5ml,加水至100ml)25ml,加邻二氮菲指示液4滴,用硫酸铈滴定液(0.1mol/L)滴定至溶液由橙红色变为浅黄绿色,并将滴定结果用空白试验校正。每1ml硫酸铈滴定液(0.1mol/L)相当于20.92mg的C21H26N2O7。
钙通道阻滞药。
遮光,密封,在干燥处保存。
杂质I

C21H24N2O7 416.42
2,6-二甲基-4-(3-硝基苯基)-3,5-吡啶二甲酸2-甲氧基乙酯异丙酯
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
