登录/
注册
登录/
注册
盐酸地匹福林
Yansuan Dipifulin
Dipivefrin Hydrochloride
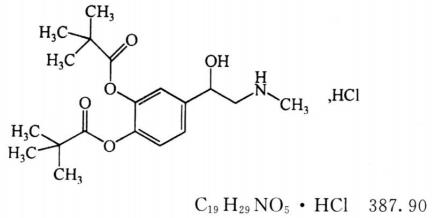
本品为(±)3,4-二羟基-Α-[(甲氨基)甲基]苯甲醇-3,4-二新戊酸酯盐酸盐。按干燥品计算,含C19H29NO5 • HC1应为98.5%~101.5%。
本品为白色或类白色结晶性粉末;无臭;有引湿性;与日光或空气接触易变质。
本品在水中极易溶解,在乙醇中易溶,在乙酸乙酯中极微溶解,在石油醚中几乎不溶。
熔点 本品的熔点(通则0612)为161~166℃,熔距在2℃以内。
(1)用于治疗开角型青光眼、高眼压症、色素性青光眼、新生血管性青光眼和手术时止血,以及与麻醉剂合用以延长麻醉时间。
(2)用于散瞳和患者瞳孔散大的鉴别诊断。
(3)用于闭角型青光眼虹膜切除后的残余青光眼,以及其他类型的继发性开角型青光眼和青光眼睫状体炎综合征。
滴入结膜囊,一次1滴,一日1~2 次。滴后用手指压迫内眦泪囊部3~5分钟。
(1)药效学 本品是肾上腺素的前药。自身没有药理活性,在角膜和前房中被组织和异戊酸形成的双酯化合物脂酶水解,转化为肾上腺素发挥药理作用,引起散瞳和眼压下降。肾上腺素为非选择性肾上腺素能受体激动剂,对α和β受体均有直接作用。地匹福林的降眼压机制同肾上腺素,主要是降低小梁网的房水流出阻力和增加葡萄膜巩膜房水流出量。
(2)药动学 本品具有亲脂性,亲脂性比肾上腺素大100~600倍,对角膜的穿透力比肾上腺素大17倍,降眼压的作用比肾上腺素大10倍,因此,用药量仅为肾上腺素的1/10。0.1%地匹福林的降眼压作用与1%肾上腺素相当、比2%肾上腺素略低,但散瞳作用与2%肾上腺素相当。滴药后30分钟开始眼压降低,1~5小时达峰值,眼压降低 0.78 kPa(5.9 mmHg),眼压下降率为20%~~27%,降眼压作用持续 12 小时。代谢的最终产物为3-甲氧基肾上腺素、二羟基扁桃酸和二羟基苯基乙二醇,代谢物大部分由尿排除,小部分由粪便排出。
地匹福林滴眼液的使用浓度仅为肾上腺素的1/10~1/20,因此不良反应的发生率比肾上腺素少得多。
(1)眼部 烧灼感、刺激感、畏光感、瞳孔轻度扩大、视物模糊、额部疼痛、结膜血管收缩后反跳性充血、结膜炎、滤泡性结膜炎和角结膜色素沉着。无晶状体眼滴用可能发生黄斑囊样水肿。
(2)全身 一般不发生副作用,偶有一过性头痛、枕部疼痛、心律失常、心悸、心率增快、血压增高、脸色苍白、发抖和出汗等。
(1)未经手术治疗的闭角型青光眼及窄房角患者禁用。
(2)严重高血压、动脉硬化、冠状动脉供血不全、心律不齐、糖尿病、甲状腺功能亢进患者禁用。
(3)对本品过敏者禁用。
(1)哺乳期妇女不宜使用,或用药期间宜暂停哺乳。
(2)小儿慎用,在确有应用指征时,应权衡利弊后决定是否使用。
(3)老年患者慎用,在确有应用指征时,应权衡利弊后决定是否使用。
(4)美国FDA 妊娠期药物安全性分级为眼部给药B。
(5)用药时应监测眼内压。
(1)与毛果芸香碱或β肾上腺索受体拮抗药合用有相加作用。
(2)与拉坦前列素合用有明显的相加作用。
地匹福林滴眼液∶(1)5ml∶5mg;(2)8 ml :8 mg。
(1)取本品约10mg,加氢氧化钠试液10ml使溶解,溶液缓缓呈淡黄色,将此溶液置紫外光灯(365nm)下观察,呈黄色荧光。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集335图)一致。
(4)本品显氯化物的鉴别反应(通则0301)。
酸度 取本品0.10g,加水10ml使溶解,依法测定(通则0631),pH值应为5.0~6.5。
溶液的澄清度与颜色 取本品,加水制成每1ml中含100mg的溶液,应澄清无色。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,精密称定,加流动相溶解并定量稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中含10μg的溶液。
对照品溶液 取杂质I对照品适量,精密称定,加流动相使溶解并定量稀释制成每1ml中约含5μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取磷酸二氢钾13.6g,加水溶解并稀释成1000ml,用10%磷酸溶液调pH值至3.5)-乙腈(60:40)为流动相;检测波长为254nm;进样体积20μl。
系统适用性要求 理论板数按地匹福林峰计算不低于1500,地匹福林峰与相邻杂质峰之间的分离度应符合要求。
测定法 精密量取供试品溶液、对照溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
限度 供试品溶液色谱图中如有杂质峰,其中与对照品溶液主峰保留时间相同的色谱峰面积不得大于对照品溶液主峰面积(0.5%);各杂质峰面积的和不得大于对照溶液主峰面积(1.0%)。
干燥失重 取本品,在60℃减压干燥6小时,减失重量不得过1.0%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.3%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十五。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含1mg的溶液。
对照品溶液 取盐酸地匹福林对照品,精密称定,加流动相溶解并定量稀释制成每1ml中约含1mg的溶液。
色谱条件与系统适用性要求 见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
眼科用药。
遮光,密封,在干燥处保存。
杂质Ⅰ
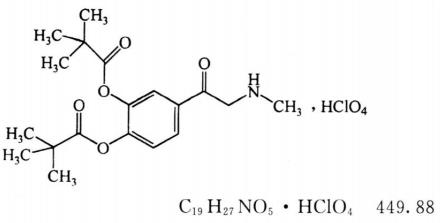
(±)3,4-二羟基-2'-甲氨基苯乙酮-3,4-二新戊酸酯高氯酸盐
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
