登录/
注册
登录/
注册
萘普待因片
Naipu Daiyin Pian
Naproxen and Codeine Phosphate Tablets
本品每片含萘普生(C14H14O3)应为标示量的 93.0%~107.0%,含磷酸可待因![]() 应为标示量的 90.0%~110.0%。
应为标示量的 90.0%~110.0%。

本品为白色或类白色片。
取本品细粉适量(约相当于磷酸可待因 0.1g、萘普生 1g),加水 15ml 与稀硫酸 5ml,超声 10 分钟,滤过,取续滤液作为鉴别用供试品溶液(1);滤渣用无水乙醇 25ml 全部转移至 50ml 锥形瓶中,超声 10 分钟,滤过,取续滤液作为鉴别用供试品溶液(2)。
(1)取供试品溶液(1)适量,置分液漏斗中加氨试液使呈碱性(pH 值约为 10),用三氯甲烷 15ml 振摇提取 1 次,三氯甲烷用少量水洗涤 1 次,分取三氯甲烷层,减压蒸干,取残渣约 1mg,置白瓷板上,加含亚硒酸 2.5mg 的硫酸 0.5ml,立即显绿色,渐变蓝色。
(2)在含量测定项下记录的色谱图中,供试品溶液两主峰的保留时间应与对照品溶液相应两主峰的保留时间一致。
(3)取供试品溶液(2)适量,加无水乙醇制成每 1ml 中约含萘普生 30μg 的溶液,照紫外-可见分光光度法(通则 0401)测定,在 262nm、271nm、317nm 与 331nm 的波长处有最大吸收。
(4)取供试品溶液(1)少量,用氢氧化钠试液调节 pH 值至中性,溶液应显磷酸盐的鉴别反应(通则 0301)。
有关物质 照薄层色谱法(通则 0502)试验。
供试品溶液 取本品细粉适量(约相当于萘普生 1.0g),精密称定,加水 15ml 与稀硫酸 5ml,超声 10 分钟,滤过,滤渣用适量无水乙醇全部转移至 25ml 量瓶中,超声 10 分钟后,用无水乙醇稀释至刻度,摇匀,滤过,取续滤液。
对照溶液 精密量取供试品溶液适量,用无水乙醇定量稀释制成每 1ml 中约含 0.20mg 的溶液。
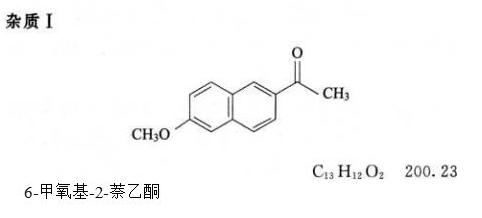
对照品溶液 取杂质 I 对照品适量,精密称定,加无水乙醇溶解并定量稀释制成每 1ml 中约含 40μg 的溶液。
色谱条件 采用硅胶 GF254 薄层板,以甲苯-四氢呋喃-冰醋酸(90:9:3)为展开剂。
测定法 上述三种溶液各 10μl,分别点于同一薄层板上,展开,晾干,置紫外光灯(254nm)下检视。
限度 供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得更深;供试品溶液如显荧光斑点,其荧光强度与对照品溶液的主斑点比较,不得更强。
含量均匀度 磷酸可待因 取本品 1 片,置 50ml 量瓶中,加 75%甲醇溶液适量,照含量测定项下的方法自“超声 10 分钟”起依法测定含量,应符合规定(通则 0941)。
溶出度 照溶出度与释放度测定法(通则 0931 第一法)测定。
溶出条件 以磷酸盐缓冲液(pH 7.4)900ml 为溶出介质,转速为每分钟 100 转,依法操作,经 30 分钟时取样。
供试品溶液 取溶出液 10ml,滤过,取续滤液。
对照品溶液 取含量测定项下的对照品溶液 5ml,置 25ml 量瓶中,用溶出介质稀释至刻度,摇匀。
色谱条件 见含量测定项下。进样体积 10μl。
系统适用性要求 见含量测定项下。
测定法 见含量测定项下。计算每片的溶出量。
限度 磷酸可待因限度为标示量的 70%,萘普生限度为标示量的 80%,应符合规定。
其他 应符合片剂项下有关的各项规定(通则 0101)。
照高效液相色谱法(通则 0512)测定。
供试品溶液 取本品 20 片,精密称定,研细,精密称取适量(约相当于萘普生 150mg、磷酸可待因 15mg),置 50ml 量瓶中,加 75%甲醇溶液适量,超声 10 分钟,用 75%甲醇溶液稀释至刻度,摇匀,滤过,精密量取续滤液 3ml,置 10ml 量瓶中,用 75%甲醇溶液稀释至刻度,摇匀。
对照品溶液 取萘普生、磷酸可待因对照品各适量,精密称定,加 75%甲醇溶解并定量稀释制成每 1ml 中约含萘普生 0.9mg 与磷酸可待因 0.09mg 的混合溶液。
色谱条件 用辛基硅烷键合硅胶为填充剂;以 0.05mol/L 磷酸二氢钾溶液-甲醇-四氢呋喃(4:6:0.04)为流动相;检测波长为 254nm;进样体积 20μl。
系统适用性要求 磷酸可待因峰与萘普生峰之间的分离度应大于 2.0。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以各自的峰面积计算。在计算磷酸可待因含量时,应将结果乘以 1.068。
镇痛药。
遮光,密封,在阴凉处保存。
中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
