登录/
注册
登录/
注册
咪达唑仑
Midazuolun
Midazolam
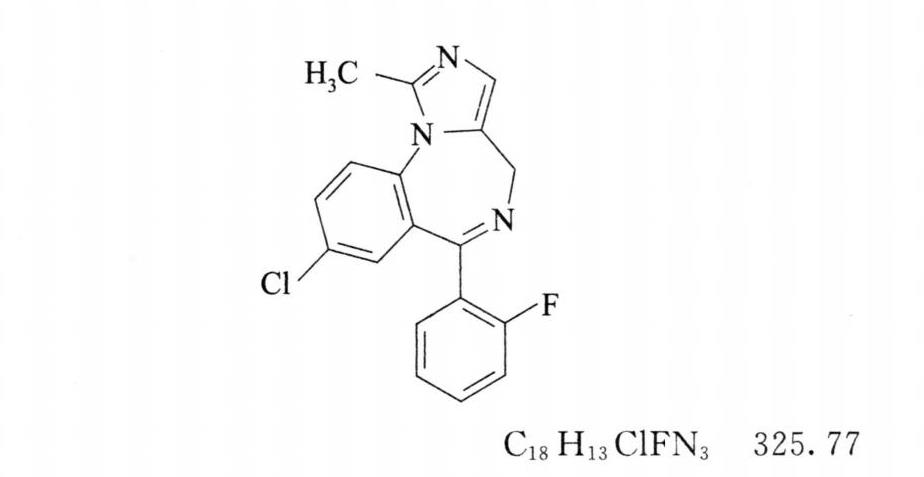
本品为1-甲基-8-氯-6-(2-氟苯基)-4H-咪唑并[1,5-α][1,4]苯并二氮杂䓬。按干燥品计算,含C18H13ClFN3应为98.5%~101.5%。
本品为白色至微黄色的结晶或结晶性粉末;无臭;遇光渐变黄。
本品在冰醋酸或乙醇中易溶,在甲醇中溶解,在水中几乎不溶。
熔点本品的熔点(通则0612第一法)为160~164℃。
镇静、催眠、全身或局部麻醉时辅助用药。
(1)口服 用于失眠症者,一次15mg,每晚1次。连续应用后作用减效,应间断服用。老年人从7.5mg开始。每晚1次。
(2)肌内注射 术前准备,术前20~30分钟注射,成人10~15mg,儿童剂量每1kg体重0.15~0.2mg。
(3)静脉注射 术前准备,术前5~10分钟注射2.5~5mg;用于诱导麻醉时,成人为10~15mg,儿童剂量可稍高,没1KG体重0.2mg;用于维持麻醉时,小剂量静脉注射,剂量及注射间隔视患者个体差异而定。
(1)药效学 咪达唑仑是一种作用时间相对较短的苯二氮草类,它对受体的亲和力较高,约为地西泮的二倍。有资料表明,咪达唑仑分别具有苯二氮草类GABA受体与离子通道(氯离子)结合和产生膜超极化与神经元抑制的两方面作用。所以认为咪达唑仑在诱导麻醉中的作用与通过神经突触部GABA沉积有关。
肌内注射后15分钟内起效,静脉注射后1.5~5分钟起效。有效作用时间一般为2小时,个别可达6小时。
(2)药动学 不同途径给药后很快吸收,达峰时间(tmax)为15~60分钟,口服后有明显首关消除,生物利用度低;肌内注射后,生物利用度超过90%。吸收后分布于全身各部位,包括脑脊液和脑,可通过胎盘,从乳汁分泌。表观分布容积为1~2L/kg(0.96~6.6L/kg)。但应注意,在充血性心力衰竭和肥胖者表观分布容积增加。血浆蛋白结合率很高,健康人中高达97%,肾功能衰竭的患者亦达93.5%。在肝脏代谢,主要代谢产物1-羟甲基咪达唑仑和4-羟咪达唑仑有部分药理作用,代谢产物多数以糖苷结合形式经尿排泄。健康人半衰期(t1/2)平均2.5小时(1~5小时),偶有长达12.3小时。新生儿、老年人和充血性心力衰竭者半衰期(t1/2)延长。肾功能不全者没有改变。两个代谢产物的半衰期(t1/2)与原形药物相似。
(1)麻醉或外科手术时最大的不良反应为降低呼吸容量和呼吸频率,发生率约为10.8%~23.3%;静脉注射后,有15%患者可发生呼吸抑制。严重的呼吸抑制易见于老年人和长期用药的老年人,可表现为呼吸暂停,窒息,心跳暂停,甚至死亡。
(2)咪达唑仑静脉注射,特别当与阿片类镇痛药合用时,可发生呼吸抑制、停止,有些患者可因缺氧性脑病而死亡。
(3)长期服用,患者可发生精神运动障碍。亦可出现肌肉颤动,躯体不能控制的运动或跳动,罕见有兴奋,不能安静等。出现这些症状时应当处理。
(4)常见的不良反应①低血压,静脉注射的发生率约为1%;②急性谵妄、朦胧、失定向、幻觉、焦虑、神经质或不安宁等。此外还有心跳增快、不规则、静脉炎、皮肤红肿、皮疹、过度换气、呼吸急促等;③肌内注射后局部硬块、疼痛;静脉注射后静脉触痛等;④恶心、呕吐、头痛、嗜睡、咳嗽、打嗝。
(5)较少见的不良反应视物模糊、轻度头痛、头晕、咳嗽、飘飘然;肌肉和静脉发硬及疼痛;手脚无力、麻痛或针刺样感等。
(1)对咪达唑仑或苯二氮草类过敏者。
(2)急性闭角型青光眼患者和未经治疗的开角型青光眼患者。
(3)美国FDA妊娠期药物安全性分级为口服给药、肠道外给药D。
(1)使用本品可引起呼吸抑制和呼吸暂停,尤其是在用于镇静的情况下。因此仅在能提供持续心肺功能监测的条件下使用。
(2)急性乙醇中毒时,与之合用将危及生命。①患者可出现昏迷或休克,低血压的作用将延长;②血性心力衰竭可使半衰期(t)延长,表观分布容积增加2~3倍;③出现肝功能损害。
(3)对重症肌无力和其他神经肌肉接头病、肌营养不良症、肌强直等患者可加重症状。
(4)对慢性阻塞性肺疾病患者,可由于呼吸抑制而出现严重的肺功能不足,慎用。
(5)在慢性肾功能衰竭者,咪达唑仑的峰浓度可比正常人增高,诱导麻醉发生更快,而且恢复延长。
(6)肝功能损害、休克、昏迷、充血性心衰以及严重的水、电解质失衡患者慎用。
(7)静脉注射时避免渗出,不能动脉注射。
(8)开角型青光眼患者仅在接受了适当的青光眼治疗后才可使用本品。
(9)严重疾病的患者、新生儿使用本品可出现低血压,尤其是在同时使用芬太尼或快速使用本品时。
(10)老年人危险性的手术和斜视、白内障切除的手术中,可推荐应用咪达唑仑,但可能会有意识朦胧或失定向的感觉。
(11)哺乳期妇女使用本品,对乳儿的危害不能排除。
(1)与乙醇或其他中枢神经系统抑制药同时应用时,可增强中枢神经系统的抑制作用,表现为心搏停止(罕见)、呼吸停止(罕见)、血压降低、麻醉复苏延长等。合用时应当减少剂量。
(2)与阿片类或其他镇痛药联合使用时,呼吸抑制、气道阻塞或肺换气不足的风险增加。
(3)与西咪替丁或雷尼替丁合并应用时,由于肝代谢降低,使咪达唑仑的血药浓度增高,半衰期(t1/2)延长。
(4)与降压药物同时应用时,可增强降压作用,因此当两药合用时,应当注意控制血压。
马来酸咪达唑仑片∶(1)7.5mg;(2)15mg。
咪达唑仑注射液∶(1)1ml∶5mg;(2)2ml:10mg;(3)3ml:15mg;(4)2ml:2mg;(5)5ml:5mg。
(1)取本品与咪达唑仑对照品,加甲醇分别溶解并稀释制成每1ml中约含10μg的溶液作为供试品溶液与对照品溶液,照有关物质项下方法,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集1084图)一致。
(3)本品显有机氟化物的鉴别反应(通则0301)。
(4)取鉴别(3)项下制备的吸收液2ml,显氯化物鉴别(2)的反应(通则0301)。
酸性溶液的澄清度与颜色 取本品0.10g,加0.1mol/L盐酸溶液10ml溶解后,溶液应澄清无色;如显色,与黄色或黄绿色1号标准比色液(通则0901第一法)比较,不得更深。
有关物质照高效液相色谱法(通则0512)测定。
供试品溶液取本品,加甲醇溶解并稀释制成每lml中含1mg的溶液。
对照溶液精密量取供试品溶液1ml,置100ml量瓶中,用甲醇稀释至刻度,摇匀。
系统适用性溶液取咪达唑仑对照品与杂质I对照品各适量,加甲醇溶解并制成每1ml中各约含10μg的溶液。
色谱条件用辛基硅烷键合硅胶为填充剂;以醋酸盐缓冲液(取醋酸铵7.7g和40%四丁基氢氧化铵溶液10ml,加水溶解并稀释至1000ml,用冰醋酸调节pH值至5.3)-甲醇(44∶56)为流动相;检测波长为254nm;进样体积10μl。
系统适用性要求系统适用性溶液色谱图中,咪达唑仑峰与杂质I峰的分离度应大于4.0。
测定法精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍。
限度供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.2%),各杂质峰面积的和不得大于对照溶液主峰面积的0.5倍(0.5%),小于对照溶液主峰面积0.05倍的色谱峰忽略不计。
干燥失重取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
取本品约0.12g,精密称定,加冰醋酸30ml溶解后,加醋酐20ml,照电位滴定法(通则0701),用高氯酸滴定液(0.1mol/L)滴定,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于16.29mg的C18H13ClFN3。
麻醉药。
遮光,密封保存。
杂质Ⅰ
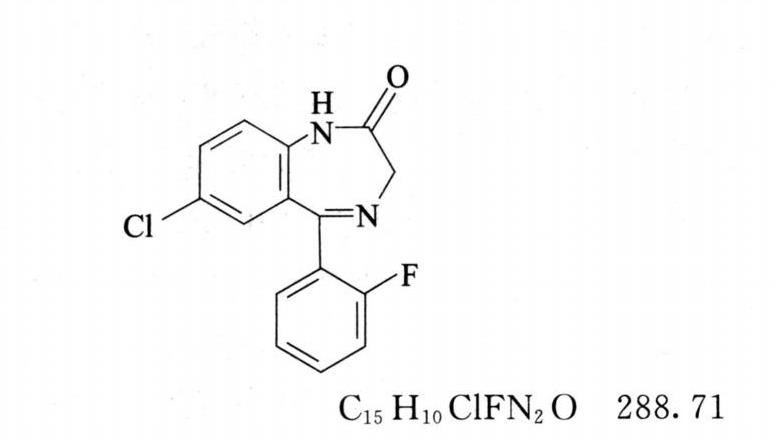
1,3-二氢-7-氯-5-(2-氟苯基)-2H-1,4-苯并二氮杂䓬-2-酮
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
