登录/
注册
登录/
注册
重组乙型肝炎疫苗(汉逊酵母)
Chongzu Yixing Ganyan Yimiao (Hanxun Jiaomu)
Recombinant Hepatitis B Vaccine (Hansenula polymorpha)
本品系由重组汉逊酵母表达的乙型肝炎(简称乙肝)病毒表面抗原(HBsAg)经纯化,加入铝佐剂制成。用于预防乙型肝炎。
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2.1 生产用菌种
2.1.1 名称及来源
以DNA重组技术构建的表达HBsAg并经批准的重组汉逊酵母工程菌株。
2.1.2 种子批的建立
应符合“生物制品生产检定用菌毒种管理及质量控制”规定。
主种子批和工作种子批的代次应符合批准的要求。
2.1.3 种子批菌种的检定
主种子批及工作种子批应进行以下全面检定。
2.1.3.1 HBsAg基因序列测定
HBsAg基因序列应与原始种子保持一致。
2.1.3.2 HBsAg外源基因和酵母MOX基因的检定
HBsAg基因DNA片段的长度和酵母MOX基因DNA片段的长度应符合批准的要求。
2.1.3.3 外源基因整合于宿主染色体中的检定
种子批菌种基因组DNA应无游离质粒DNA电泳条带;扩增的PCR产物中应有HBsAg外源基因DNA电泳条带。
2.1.3.4 HBsAg外源基因拷贝数检定
种子批菌种采用杂交法或经批准的方法检测,整合HBsAg基因拷贝数应符合批准的要求。
2.1.3.5 整合基因稳定性试验
种子批菌种培养160小时,应符合2.1.3.4项要求。
2.1.3.6 培养物纯度
将菌种接种至酵母完全培养基中,于33℃培养14~18小时后,将培养物分别接种于胰酪胨大豆肉汤培养基与液体硫乙醇酸盐培养基,于30~35℃培养7天,应无细菌和其他真菌检出。
2.1.4 菌种保存
种子批保存应符合批准的要求。
2.2 原液
2.2.1 发酵
取工作种子批菌种,按批准的工艺培养发酵,收获的酵母菌应冷冻保存。
2.2.2 培养物的检定
2.2.2.1 HBsAg外源基因拷贝数检定
按2.1.3.4项进行。
2.2.2.2 培养物纯度
将培养物分别接种于胰酪胨大豆肉汤培养基与液体硫乙醇酸盐培养基,于30~35℃培养7天,应无细菌和其他真菌检出。
2.2.3 纯化
采用适宜的方法破碎汉逊酵母,离心除去细胞碎片,用硅胶吸附,柱色谱法和溴化钾密度梯度离心法或其他适宜方法纯化HBsAg后,进行除菌过滤,即为原液。
2.2.4 原液检定
按3.1项进行。
2.2.5 原液保存
于2~8℃保存,保存时间应符合批准的要求。
2.3 半成品
2.3.1 甲醛处理
原液用甲醛溶液处理,甲醛浓度、处理温度及时间等条件按批准的工艺执行。
2.3.2 铝吸附
将抗原与铝佐剂按经批准的工艺进行吸附。
2.3.3 配制
按批准的工艺,将吸附的抗原采用适宜的溶液稀释至规定的蛋白质浓度,即为半成品。
2.3.4 半成品检定
按3.2项进行。
2.4 成品
2.4.1 分批
应符合“生物制品分包装及贮运管理”规定。
2.4.2 分装
应符合“生物制品分包装及贮运管理”规定。
2.4.3 规格
每瓶/支0.5ml。每1次人用剂量0.5ml,含HBsAg 10μg或20μg。
2.4.4 包装
应符合“生物制品分包装及贮运管理”规定。
3.1 原液检定
3.1.1 无菌检查
依法检查(通则1101),应符合规定。
3.1.2 蛋白质含量
依法测定(通则0731第二法),应符合批准的要求。
3.1.3 分子量
采用还原型SDS-聚丙烯酰胺凝胶电泳(通则0541第五法),分离胶胶浓度15%,上样量为0.5μg,银染法染色。主要蛋白质条带的分子质量应为20~25kD;可有多聚体蛋白带。
3.1.4 纯度
采用分子排阻色谱法(通则0514),亲水甲基丙烯酸树脂体积排阻色谱柱;排阻极限10000kD;孔径100nm;粒度17μm;流动相为含0.05%叠氮钠的1mmol/L PBS(pH7.0);上样量10μl;检测波长280nm,按面积归一化法计算,HBsAg含量应不低于99.0%。或采用经批准的方法检测,纯度应符合批准的要求。
3.1.5 细菌内毒素检查
应小于5EU/ml(通则1143凝胶限度试验)。
3.1.6 宿主细胞DNA残留量
应不高于10ng/剂(通则3407)。
3.1.7 宿主细胞蛋白质残留量
应不超过总蛋白质含量的1.0%(通则3414)。
3.1.8 N端氨基酸序列测定(每年至少测定1次)
用氨基酸序列分析仪或其他适宜的方法测定,N端氨基酸序列应为:
(Met)-Glu-Asn-Ile-Thr-Ser-Gly-Phe-Leu-Gly-Pro-Leu-Leu-Val-Leu。
3.1.9 聚山梨酯20残留量
应不高于10μg/20μg蛋白质(通则3203)。
3.2 半成品检定
3.2.1 无菌检查
依法检查(通则1101),应符合规定。
3.2.2 pH值
应为5.5~7.0(通则0631)。
3.2.3 铝含量
应符合批准的要求且铝含量不高于0.62mg/ml(通则3106)。
3.2.4 细菌内毒素检查
应小于5EU/ml(通则1143凝胶限度试验)。
3.2.5 吸附完全性试验
将供试品于6500g离心5分钟取上清液,依法测定(通则3501)参考品、供试品及其上清液中HBsAg含量。以参考品HBsAg含量的对数对其相应吸光度对数作直线回归,相关系数应不低于0.99,将供试品及其上清液的吸光度值代入直线回归方程,计算其HBsAg含量,再按下式计算吸附率,应不低于95%。
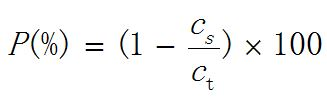
式中 P为吸附率,%;
cs为供试品上清液的HBsAg含量,μg/ml;
ct为供试品的HBsAg含量,μg/ml。
3.2.6 渗透压摩尔浓度
依法检查(通则0632),应符合批准的要求。
3.3 成品检定
3.3.1 鉴别试验
采用酶联免疫吸附法(通则3429)检查,应证明含有HBsAg。
3.3.2 外观
应为乳白色混悬液体,可因沉淀而分层,易摇散,不应有摇不散的块状物。
3.3.3 装量
依法检查(通则0102),应不低于标示量。
3.3.4 渗透压摩尔浓度
依法检查(通则0632),应符合批准的要求。
3.3.5 化学检定
3.3.5.1 pH值
应为5.5~7.0(通则0631)。
3.3.5.2 铝含量
应符合批准的要求且铝含量不高于0.62mg/ml(通则3106)。
3.3.5.3 游离甲醛含量
如生产中使用,应不高于15μg/ml(通则3207第二法)。
3.3.5.4 聚乙二醇6000残留量
如生产中使用,应小于200μg/ml。
3.3.6 体外相对效力测定
应不低于1.0(通则3501)。
3.3.7 无菌检查
依法检查(通则1101),应符合规定。
3.3.8 异常毒性检查
依法检查(通则1141),应符合规定。
3.3.9 细菌内毒素检查
应小于5EU/ml(通则1143凝胶限度试验)。
于2~8℃避光保存和运输。自生产之日起,有效期按批准的执行。
应符合“生物制品分包装及贮运管理”规定和批准的内容。
中华人民共和国药典:2020年版.三部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1575-9
