登录/
注册
登录/
注册
注射用人白介素-11
Zhusheyong Ren Baijiesu-11
Human Interleukin-11 for Injection

本品系由高效表达人干扰素α2a基因的大肠埃希菌或甲醇酵母,经发酵、分离和高度纯化后获得的人白介素-11冻干制成。含适宜稳定剂,不含抑菌剂和抗生素。
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2.1 工程菌菌种
2.1.1 名称及来源
人白介素-11工程菌株系由带有人白介素-11基因的重组质粒转化的大肠埃希菌或甲醇酵母菌株。
2.1.2 种子批的建立
种子批的建立应符合“生物制品生产检定用菌毒种管理及质量控制"的规定,各级种子批的传代应符合批准的要求。
2.1.3 菌种检定
主种子批和工作种子批的菌种应进行以下各项全面检定。
2.1.3.1 划种平板
釆用大肠埃希菌为载体的,其菌种划种LB琼脂平板,应呈典型大肠埃希菌集落形态;采用甲醇酵母为载体的,其菌种划种YPD平板,应呈典型甲醇酵母集落形态。须无其他杂菌生长。
2.1.3.2 染色镜检
采用大肠埃希菌为载体的,其菌种应为典型的革兰氏阴性杆菌。
2.1.3.3 His+表型检查
甲醇酵母菌种应呈His+表型,与原始菌种相符。
2.1.3.4 对抗生素的抗性
采用大肠埃希菌为载体的,其对抗生素的抗性应与原始菌种相符。
2.1.3.5 电镜检查(工作种子批可免做)
应分别为典型大肠埃希菌或甲醇酵母形态,无支原体、病毒样颗粒及其他微生物污染。
2.1.3.6 生化反应
釆用大肠埃希菌为载体的,其菌种应符合大肠埃希菌生化反应特性。
2.1.3.7 人白介素-11表达量
在摇床中培养,应不低于原始菌种的表达量。
2.1.3.8 质粒检查
采用大肠埃希菌为载体的,其菌种中转化质粒的酶切图谱应与原始重组质粒的相符。
2.1.3.9 目的基因核苷酸序列检查(工作种子批可免做)
采用大肠埃希菌为载体的,其菌种中目的基因核苷酸序列应与批准的序列相符。
2.1.3.10 人白介素-11基因稳定性检查
采用甲醇酵母为载体的,菌种涂YPD平板,挑选至少50个克隆,用聚合酶链反应检测人白介素-11基因,阳性率应不低于95%。
2.1.3.11 表达物鉴定
采用甲醇酵母为载体的,菌种釆用免疫印迹法检测,应与人白介素-11对照品一致。
2.2 原液
2.2.1 种子液制备
将检定合格的工作种子批菌种接种于适宜的培养基(大肠埃希菌培养基可含适量抗生素)中培养。
2.2.2 发酵用培养基
釆用适宜的不含抗生素的培养基。
2.2.3 种子液接种及发酵培养
2.2.3.1 在灭菌培养基中接种适量种子液。
2.2.3.2 在适宜的温度下进行发酵,应根据经批准的发酵工艺进行,并确定相应的发酵条件,如温度、pH值、溶解氧、补料、发酵时间等。发酵液应定期进行质粒丢失率检查(通则3406)。
2.2.4 发酵液处理
采用大肠埃希菌为载体的,用适宜的方法收集、处理菌体;采用甲醇酵母为载体的,用适宜的方法收集、发酵上清液。
2.2.5 初步纯化
采用经批准的纯化工艺进行初步纯化,使其纯度达到规定的要求。
2.2.6 高度纯化
经初步纯化后,釆用经批准的纯化工艺进行高度纯化,使其达到3.1项要求,加入适宜稳定剂,除菌过滤后即为人白介素-11原液。如需存放,应规定保存温度和时间。
2.2.7 原液检定
按3.1项进行。
2.3 半成品
2.3.1 配制与除菌
按经批准的配方配制稀释液,配制后应立即用于稀释。将原液用稀释液稀释至所需浓度,除菌过滤后即为半成品,保存于2~8℃。
2.3.2 半成品检定
按3.2项进行。
2.4 成品
2.4.1 分批
应符合“生物制品分包装及贮运管理”规定。
2.4.2 分装及冻干
应符合“生物制品分包装及贮运管理”与通则0102有关规定。
2.4.3 规格
600万U(0.75mg)/瓶;800万U(lmg)/瓶;1200万U(1.5mg)/瓶;1600万U(2mg)/瓶;2400万U(3mg)/瓶;4000万U(5mg)/瓶
2.4.4 包装
应符合“生物制品分包装及贮运管理”与通则0102有关规定。
3.1 原液检定
3.1.1 生物学活性
依法测定(通则3532)。
3.1.2 蛋白质含量
采用Lowry法(通则0731第二法)或高效液相色谱法(通则0512)测定。
采用高效液相色谱法,色谱柱采用十八烷基硅烷键合硅胶为填充剂,柱温30℃±5℃,供试品保存温度为2~8℃;以0.1%三氟乙酸的水溶液为流动相A,以0.1%三氟乙酸的乙腈溶液为流动相B;流速为1.0ml/min;检测波长214nm;按下表进行梯度洗脱。
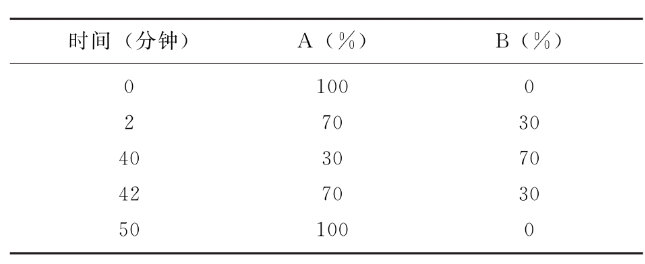
检测法 取标准品和供试品,用流动相A复溶或稀释至相同蛋白浓度,将供试品与标准品以相同体积分别注入液相色谱仪(进样体积不小于10μl,进样量4~6μg),按上表进行梯度洗脱。标准品溶液、供试品溶液均进样3次,记录色谱图并计算峰面积。按外标法以峰面积计算供试品中白介素-11的含量。
3.1.3 比活性
为生物学活性与蛋白质含量之比。采用大肠埃希菌表达的产物,每lmg蛋白质应不低于8.0×106U;采用甲醇酵母表达的产物,每lmg蛋白质应不低于7.0×106U。
3.1.4 纯度
3.1.4.1 电泳法
依法测定(通则0541第五法)。取供试品溶液(不进行水浴加热处理),用非还原型SDS-聚丙烯酰胺凝胶电泳法,分离胶的胶浓度为15%,加样量应不低于10μg(考马斯亮蓝R250染色法)。经扫描仪扫描,纯度应不低于95.0%。
3.1.4.2 高效液相色谱法(反相色谱法)
(1)方法一(采用大肠埃希菌表达的制品)
依法测定(通则0512)。色谱柱采用十八烷基硅烷键合硅胶为填充剂;配制流动相A(三氟乙酸-水溶液:量取1.0ml三氟乙酸加水至1000ml,充分混匀)、流动相B(三氟乙酸-乙腈溶液:量取1.0ml三氟乙酸加入100ml水再加入色谱纯乙腈至1000ml,充分混匀),在室温条件下,进行梯度洗脱(55%~80%流动相B,0~40分钟)。上样量约为20μg,检测波长为214nm,理论板数按人白介素-11峰计算不低于1500。按面积归一化法计算,人白介素-11主峰面积应不低于总面积的95.0%。

(2)方法二(采用甲醇酵母表达的制品)
依法测定(通则0512)。色谱柱采用十八烷基硅烷键合硅胶为填充剂;配制流动相A(三氟乙酸-水溶液:量取1.0ml三氟乙酸加水至1000ml,充分混匀)、流动相B(三氟乙酸-乙腈溶液:量取1.0ml三氟乙酸加入色谱纯乙腈至1000ml,充分混匀),在室温条件下,进行梯度洗脱(0~30%流动相B,0~2分钟;30%~70%流动相B,2~40分钟)。上样量约为20μg,检测波长为214nm,理论板数按人白介素-11峰计算不低于1500。按面积归一化法计算,人白介素-11主峰面积应不低于总面积的95.0%。

3.1.4.3 高效液相色谱法(分子排阻色谱法)
釆用大肠埃希菌的制品依法测定(通则0512)。色谱柱以适合分离分子质量为5~150kD蛋白质的色谱用凝胶为填充剂;流动相为0.1mol/L磷酸盐-0.1mol/L氯化钠缓冲液,pH7.0;上样量应不低于20μg,检测波长为280nm。理论板数按人白介素-11峰计算不低于1500。按面积归一化法计算,人白介素-11主峰面积应不低于总面积的95.0%。
3.1.5 分子量
依法测定(通则0541第五法)。取供试品溶液(不进行水浴加热处理),用还原型SDS-聚丙烯酰胺凝胶电泳法,分离胶的胶浓度为15%,加样量应不低于1.0μg,制品的表观分子质量应与对照品的一致,经对照品分子量校正,制品的表观分子质量应为19.0kD±1.9kD。
3.1.6 外源性DNA残留量
每1支/瓶应不高于10ng(通则3407)。
3.1.7 宿主菌蛋白质残留量
应不高于蛋白质总量的0.05%(通则3412、通则3414)。
3.1.8 残余抗生素活性
依法测定(通则3408),采用大肠埃希菌表达的制品不应有残余氨苄西林或其他抗生素活性。
3.1.9 细菌内毒素检查
依法检查(通则1143),每1支/瓶应小于10EU。
3.1.10 羟胺残留量
如制品工艺中采用羟胺,则照羟胺残留量测定法(通则3209)进行。每1.0mg蛋白质应小于100nmol。
3.1.11 等电点
依法测定(通则0541第六法),等电点图谱应与对照品一致。
3.1.12 紫外光谱
用水或0.85%~0.90%氯化钠溶液将供试品稀释至0.1~0.7mg/ml,在光路1cm、波长230~360nm下进行扫描,最大吸收峰波长应为280nm±3nm(通则0401)。
3.1.13 肽图
依法测定(通则3405),肽图图谱应与对照品图形一致。
3.1.14 N端氨基酸序列(至少每年测定1次)
用氨基酸序列分析仪测定,N端序列应为:
(Met-Pro)-Gly-Pro-Pro-Pro-Gly-Pro-Pro-Arg-Val-Ser-Pro-Asp-Pro-Arg-Ala。
3.2 半成品检定
3.2.1 细菌内毒素检查
依法检查(通则1143),每1支/瓶应小于10EU。
3.2.2 无菌检查
依法检查(通则1101),应符合规定。
3.3 成品检定
除水分测定、装量差异检查外,应按标示量加入灭菌注射用水,复溶后进行其余各项检定。
3.3.1 鉴别试验
按免疫印迹法(通则3401)或免疫斑点法(通则3402)测定,应为阳性。
3.3.2 物理检查
3.3.2.1 外观
应为白色或类白色/微黄色疏松体。
3.3.2.2 溶液的澄清度
取本品,按标示量加入灭菌注射用水,复溶后溶液应澄清。如显浑浊,应与1号浊度标准液(通则0902)比较,不得更浓。
3.3.2.3 可见异物
依法检查(通则0904),除允许有少量细小蛋白质絮状物或蛋白质颗粒外,其余应符合规定。
3.3.2.4 装量差异
依法检查(通则0102),应符合规定。
3.3.3 化学检定
3.3.3.1 水分
应不高于3.0%(通则0832第一法)。
3.3.3.2 pH值
应为6.5~7.5(通则0631)。
3.3.3.3 渗透压摩尔浓度
依法测定(通则0632),应符合批准的要求。
3.3.4 甘氨酸含量
如制品中加甘氨酸,则依法测定(通则0512),应符合批准的要求。
3.3.5 蛋白质含量
按3.1.2项进行,应为标示量的80%~120%。
3.3.6 生物学活性
依法测定(通则3532),应为标示量的80%~150%。
3.3.7 残余抗生素活性
依法测定(通则3408),采用大肠埃希菌表达的制品不应有残余氨苄西林或其他抗生素活性。
3.3.8 无菌检查
依法检查(通则1101),应符合规定。
3.3.9 细菌内毒素检查
依法检查(通则1143),每1支/瓶应小于10EU。
3.3.10 异常毒性检查
依法检查(通则1141小鼠试验法),应符合规定。
3.3.11 甲醇残留量
如工艺中使用甲醇,则依法测定(通则0521)。色谱柱采用石英毛细管柱,柱温40℃,进样口温度200℃,检测器温度250℃,顶空瓶平衡温度为85℃,平衡时间为30分钟,载气为氮气,流速为每分钟4.0ml。用水稀释甲醇标准溶液使其浓度为0.003%,分别吸取5.0ml上述标准溶液和供试品溶液顶空进样相同体积,通过比较标准品溶液和供试品溶液的峰面积判定供试品溶液甲醇含量。甲醇残留量应不高于0.003%。
稀释剂应为灭菌注射用水,稀释剂的生产应符合批准的要求。
灭菌注射用水应符合本版药典(二部)的相关要求。
于2~8℃避光保存和运输。自生产之日起,按批准的有效期执行。
应符合“生物制品分包装及贮运管理”规定和批准的内容。
中华人民共和国药典:2020年版.三部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1575-9
