登录/
注册
登录/
注册
甲磺酸多沙唑嗪
Jiahuangsuan Duoshazuoqin
Doxazosin Mesylate
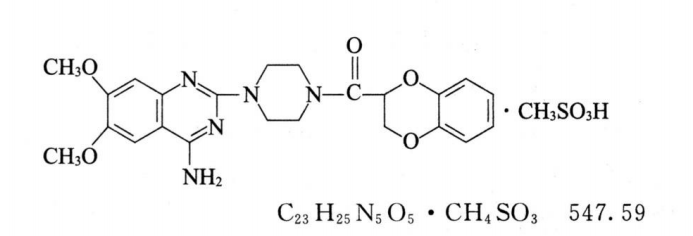
本品为1-(4-氨基-6,7-二甲氧基-2-喹唑啉基)-4-(1,4-苯并二噁烷-2-甲酰基)哌嗪甲磺酸盐。按干燥品计算,含C23H25N5O5•CH4SO3应为98.0%~102.0%。
本品为白色或类白色结晶性粉末;无臭,无味。
本品在二甲基亚砜中溶解,在水、甲醇或乙醇中微溶。
①高血压。②良性前列腺增生。
口服 成人开始一次1mg,一日1次,睡前服,以后按患者需要和耐受调整剂量。但超过4mg较多引起直立性低血压。维持量为1~8mg,一日1次。
(1)药效学 本品具选择性突触后α1肾上腺受体拮抗作用而引起周围血管扩张外,周阻力下降而降低血压,用于治疗高血压;由于拮抗α,肾上腺受体而使膀胱颈、前列腺、前列腺包膜平滑肌松弛,从而使尿道阻力和压力,膀胱阻力减低而减轻尿道症状,用于治疗良性前列腺增生。此外本品对血脂有良性作用;轻度降低总胆固醇、低密度脂蛋白和三酰甘油,刺激脂蛋白酶活性和减少胆固醇吸收,然而其临床意义尚不清。
(2)药动学 胃肠道吸收好,生物利用度约65%,口服后达峰浓度时间为1.5~3.6小时,稳态时血浆峰浓度与剂量呈正线性关系。口服本品1mg,标准化峰浓度是9.6μg/L。单剂量抗高血压峰作用时间为5~6小时,作用持续24小时。对高血压者,给药1小时内血压轻度下降,2小时后降压作用明显。对良性前列腺增生1~2周起作用。与蛋白结合率达98%~99%。在肝脏广泛代谢,虽然已确认几种活性和非活性代谢物,但其量不足以产生作用。t1/2为19~22小时,不受年龄或轻到中度肾功受损的影响。主要由粪便排出,5%为原形,63%~65%为代谢产物,肾脏排泄9%。血液透析不能清除本品。
(1)常见头晕、头痛、乏力。
(2)较少见心律失常、恶心、神经质、不安、易激惹、嗜睡,首次剂量后可出现直立性低血压,水钠不足时以及运动后易发生低血压现象,发生与剂量有关。腿下部和足部水肿。
美国FDA妊娠期药物安全性分级为口服给药C。
(1)对喹唑啉类(如哌唑嗪,特拉唑嗪)过敏者亦可对本品过敏。
(2)本品是否排入乳汁在人体不详,然而鼠给予单一剂量1mg/kg,积聚于乳汁中浓度最高可20倍于血浆浓度。
(3)老年高血压者可能有明显低血压反应,须减少每日维持量。
(4)出现逾量反应时,宜平卧位,抬高下肢,可补充血容量和升压药。
(1)吲哚美辛或其他非甾体抗炎药物与本品同用可减弱降压作用。可能由于抑制肾前列腺素合成和(或)引起水、钠潴留。
(2)西咪替丁可轻度增加多沙唑嗪血药浓度,但其临床意义尚不详。
(3)雌激素与本品合用,由于液体潴留而使降压作用减弱。
(4)其他降压药与本品同用降压作用增强,需调整剂量。
(5)拟交感胺类与本品合用可使前者升压作用与后者降压作用均减弱。
甲磺酸多沙唑嗪片∶(1)1mg;(2)2mg;(3)4mg。
多沙唑嗪缓释片:4mg。
(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集733图)一致。
氯化物 取本品0.1g,加水40ml,置水浴中加热使溶解,放冷,加稀硝酸20ml,摇匀,使甲磺酸析出,滤过,取滤液30ml,依法检查(通则0801),与标准氯化钠溶液3.0ml制成的对照液比较,不得更浓(0.06%)。
有关物质 照高效液相色谱法(通则0512)测定。
溶剂 水-2%磷酸乙腈溶液(9:1)。
供试品溶液 取本品约60mg,精密称定,置100ml量瓶中,加2%磷酸乙腈溶液10ml使溶解(必要时超声助溶),用水稀释至刻度,摇匀。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用溶剂稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用溶剂稀释至刻度,摇匀。
系统适用性溶液 取甲磺酸多沙唑嗪约60mg,加2%磷酸乙腈溶液2ml溶解,加盐酸1ml,置90℃水浴加热10分钟,放冷,加2%磷酸乙腈溶液8ml,混匀,用2mol/L的氢氧化钠溶液调节pH值至约1.9,用水稀释制成每1ml中约含0.6mg的溶液。
灵敏度溶液 精密量取对照溶液5ml,置10ml量瓶中,用溶剂稀释至刻度,摇匀。
色谱条件 用辛基硅烷键合硅胶为填充剂(Zorbax SB-C8柱,4.6mm×250mm,5μm,或效能相当的色谱柱);以5%磷酸溶液为流动相A,乙腈为流动相B,水为流动相C;按下表进行线性梯度洗脱;流速为每分钟0.8ml;检测波长为210nm;柱温35℃;进样体积10μl。
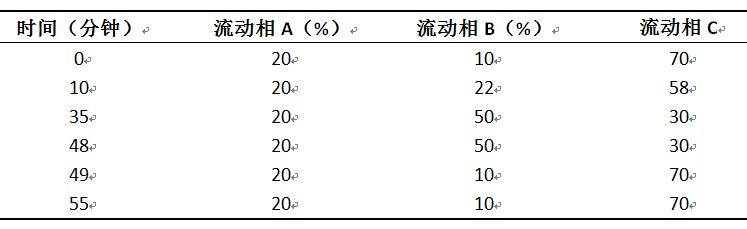
系统适用性要求 系统适用性溶液色谱图中,多沙唑嗪峰保留时间约为27分钟,多沙唑嗪峰与杂质Ⅰ峰(相对保留时间约为0.9)之间的分离度应大于2.0。灵敏度溶液色谱图中,多沙唑嗪峰的信噪比应大于10。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度 供试品溶液色谱图中如有杂质峰,杂质Ⅰ峰面积乘以校正因子1.3后不得大于对照溶液主峰面积(0.1%),其他单个杂质峰面积不得大于对照溶液主峰面积(0.1%),杂质Ⅰ峰面积乘以校正因子1.3后与其他单个杂质峰面积的和不得大于对照溶液主峰面积的3倍(0.3%),小于灵敏度溶液主峰面积的色谱峰忽略不计。
残留溶剂 照残留溶剂测定法(通则0861第二法)测定。
供试品溶液 取本品约1.0g,精密称定,置顶空瓶中,精密加入二甲基亚砜4ml使溶解,摇匀,密封。
对照品溶液 取甲醇、二氯甲烷、三氯甲烷、苯与N,N-二甲基甲酰胺各适量,精密称定,用二甲基亚砜溶解并定量稀释制成每1ml中含甲醇、二氯甲烷、三氯甲烷、苯与N,N-二甲基甲酰胺分别约为750μg、150μg、15μg、0.5μg与220μg的混合溶液,精密量取4ml,置顶空瓶中,密封。
色谱条件 以14%氰丙基苯基-86%二甲基聚硅氧烷为固定液(或极性相似)的毛细管柱;起始温度30℃,维持11分钟,以每分钟10℃的速率升温至100℃,维持4分钟,再以每分钟40℃的速率升温至200℃,维持1分钟;进样口温度为230℃,检测器温度为250℃;顶空瓶平衡温度为130℃,平衡时间为40分钟。
系统适用性要求 对照品溶液色谱图中,各成分峰间的分离度均应符合要求。
测定法 取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度 按外标法以峰面积计算,甲醇、二氯甲烷、三氯甲烷、苯与N,N-二甲基甲酰胺的残留量均应符合规定。
干燥失重 取本品,在105℃减压干燥至恒重,减失重量不得过1.0%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品约40mg,精密称定,置100ml量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液 取甲磺酸多沙唑嗪对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含40μg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以甲醇-磷酸盐缓冲液(取磷酸二氢钾3.4g,加水800ml和三乙胺4.0ml溶解,用磷酸调节pH值至4.5,用水稀释至1000ml)(55:45)为流动相;检测波长为245nm;进样体积20μl。
系统适用性要求 理论板数按多沙唑嗪峰计算不低于2000。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
抗高血压药。
遮光,密封保存。
杂质Ⅰ
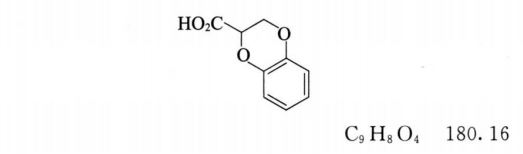
2,3-二氢苯并[b][1,4]二噁英-2-羧酸
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
