登录/
注册
登录/
注册
阿昔莫司
Aximosi
Acipimox
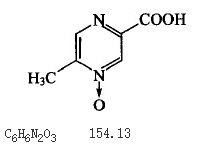
本品为5-甲基吡嗪-2-甲酸 4-氧化物。按干燥品计算,含C6H6N2O3不得少于98.5%。
本品为白色至微黄色粉末或结晶性粉末;无臭或有微臭。
本品在水中略溶,在乙醇、甲醇、丙酮或三氯甲烷中微溶;在0.1mol/L盐酸溶液中略溶。
熔点 本品的熔点(通则0612)为187~191℃,熔融时同时分解。
①高三酰甘油血症(Ⅳ型)。②高胆固醇血症(Ⅱa型),混合型高脂血症(Ⅱb型)。
口服 成人一次250mg,一日2~3次,饭后服用。剂量可按需要调整,但最大剂量不超过一日1200mg。肾功能障碍时按肌酐清除率调整剂量,40~80ml/min者一日1次250mg;20~40ml/min者时隔日1次250mg。
(1)药效学 本品为烟酸类衍生化合物,降血脂作用有多种机制。本品使脂肪组织的分解减少,因而血浆中游离脂肪酸水平减低,由此肝内所合成的极低密度脂蛋白减少,血中TG随之而减少。本品增高脂蛋白脂酶的活性,促进VLDL分解代谢,使血TG水平降低,VLDL分解后中IDL和LDL数减少。本品也使肝清除IDL增加,血LDL水平减低。本品还使血HDLC水平增高。治疗1个月内可见降血脂疗效。
(2)药动学 本品口服后吸收迅速完全,2小时后血药浓度达峰值。半衰期约为2小时。本品不与血浆蛋白结合,在体内不被代谢,以药物原形经肾排出。
(1)较多见由皮肤血管扩张所致的潮热感、瘙痒。
(2)少见胃灼热感、上腹痛、头痛、哮喘。
(3)罕见免疫变态反应所致的荨麻疹、斑丘疹、皮疹、唇水肿、哮喘样呼吸困难、低血压。
(1)对本品有过敏史者。
(2)有消化性溃疡者。
(1)由于本品在妊娠期的安全性未定,故在妊娠期妇女不推荐使用。
(2)本品是否排入乳汁尚不清楚,故不推荐用于哺乳期妇女。
(3)在儿童中的安全性未确立,故不宜应用。
(4)用药期间随访检查血脂、肝和肾功能。
阿昔莫司胶囊∶250mg。
(1)取本品,加水溶解并稀释制成每1ml中约含8μg的溶液,照紫外-可见分光光度法(通则0401)测定,在225nm与264nm的波长处有最大吸收。
(2)在有关物质项下记录的色谱图中,供试品溶液主峰的保留时间应与系统适用性溶液中阿昔莫司峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集966图)一致。
酸度 取本品,加水溶解并稀释制成每1ml中约含6mg的溶液,依法测定(通则0631),pH值应为1.5~3.5。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,精密称定,加流动相溶解并定量稀释制成每1ml中约含0.2mg的溶液。
对照溶液 精密量取供试品溶液适量,用流动相定量稀释制成每1ml中约含1μg的溶液。
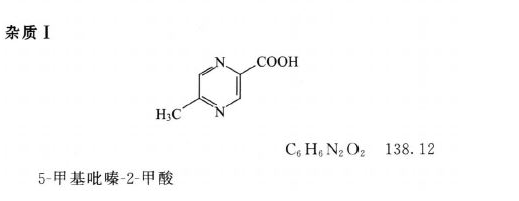
对照品溶液 取杂质 I 对照品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含1μg的溶液。
系统适用性溶液 取阿昔莫司与杂质 I 对照品各适量,加流动相溶解并稀释制成每1ml中分别约含200μg与2μg的混合溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;甲醇-0.01mol/L四丁基氢氧化铵溶液(15:85)(用磷酸调节pH值至6.0)为流动相,检测波长为264nm;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,理论板数按阿昔莫司峰计算不低于6000,阿昔莫司峰与杂质 I 峰之间的分离度应符合要求。
测定法 精密量取供试品溶液、对照溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
限度 供试品溶液色谱图中,如有与杂质 I 峰保留时间一致的色谱峰,按外标法以峰面积计算不得过0.5%;其他单个杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.1%),其他各杂质峰面积的和不得大于对照溶液的主峰面积(0.5%)。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法测定(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法测定(通则0821第二法),含重金属不得过百万分之二十。
取本品约0.3g,精密称定,加水50ml溶解后,加酚酞指示液1滴,用氢氧化钠滴定液(0.1mol/L)滴定至溶液由无色变为粉红色,并将滴定的结果用空白试验校正。每1ml氢氧化钠滴定液(0.1mol/L)相当于15.41mg的C6H6N2O3。
降血脂药。
密封保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
