登录/
注册
登录/
注册
非那雄胺
Feinaxiongan
Finasteride
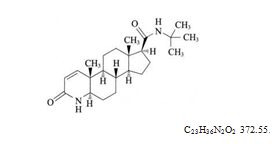
本品为N-叔丁基-3-氧代-4-氮杂-5α-雄甾-1-烯-17β-甲酰胺。按干燥品计算,含C23H36N2O2应为98.0%~102.0%。
本品为白色或类白色结晶性粉末;无臭。
本品在甲醇、乙醇中易溶,在乙腈、乙酸乙酯中略溶,在水中几乎不溶;在冰醋酸中易溶。
比旋度 取本品约0.5g,精密称定,置50ml量瓶中,加甲醇使溶解并稀释至刻度,摇匀,依法测定(通则0621),比旋度为+12°至+14°。
良性前列腺增生症。
口服 成人 一次5mg,一日1次。
肾功能不全患者(肌酐清除率不低于9ml/min)不需调整剂量。70岁以上患者本品清除率有所降低,但不需调整剂量。
非那雄胺是5α-还原酶的竞争性抑制药,而5α-还原酶将睾酮转化为双氢睾酮。非那雄胺与雄激素受体无亲和性。
(1)药效学 本品为 4-氮杂甾体化合物,是睾酮代谢成为更强的雄激素双氢睾酮(DHT)过程中的细胞内酶——Ⅱ型5α-还原酶的特异性抑制药。本品与Ⅱ型5α-还原酶缓慢形成稳定的酶复合物,减少血液和前列腺内DHT,此过程非常缓慢(t1/2为30天)。药物本身对雄激素受体无亲和性。单剂量给予本品5mg可使DHT 浓度快速下降,最大效应出现于给药后8小时。
本品血浆浓度在24小时内有变化,但血清DHT水平保持不变。BPH患者以5mg/d剂量服用本品4年后,血中DHT浓度平均降低70%,前列腺体积缩小约10%,前列腺特异性抗原(PSA)比基线值降低约50%。睾酮的血循环水平约增加10%~20%,但仍在生理水平范围内。在一项随机、双盲、安慰剂对照的多中心研究(PLESS)中,3016名中至重度前列腺增生患者服用本品4年,使泌尿系统事件(前列腺切除术或急性尿潴留需插入导管)的总危险性降低51%,前列腺体积显著且持续缩小,最大尿流率持续增高,症状改善。本品治疗对其他内分泌无影响,对肝、肾及消化系统均无损害。
(2)药动学 口服吸收,生物利用度约为80%,不受食物影响,在给药6~8小时后完全吸收,tmu为1~2小时。药物除分布于血液和组织中,也可通过血-脑屏障,并进入精液。血浆蛋白结合率为90%,在肝脏代谢。主要以代谢产物形式经尿液和粪便排泄;消除半衰期为6小时(年龄≤60岁),8小时(年龄≥70岁),但不必因此而调整剂量。血浆清除率约为165ml/min,分布容积约76L。男性单剂量口服给予14C非那雄胺后,39%以代谢产物的形式从尿液中排泄,57%从粪便中排泄。非那雄胺的代谢产物对5α-还原酶的抑制作用活性很小。每天给药5 mg重复应用后,非那雄胺血药浓度的稳态谷值为8~10ng/ml,并持续稳定一段时间,可有少量缓慢蓄积。
慢性肾功能不全(肌酐清除率在9~55ml/min)者,给予本品后的体内分布和血浆蛋白结合无改变,部分由肾脏排泄的代谢产物从粪便中排泄。因此伴有肾功能损害的非透析患者不需要调整药量。
(1)主要是性功能受影响(阳痿、性欲降低、射精障碍)和乳房不适(乳腺增生及乳房肿胀、触痛),可有皮疹。上述不良反应随治疗时间延长逐年减少。
本品上市后报道的其他不良反应包括瘙痒感、风疹、面唇部肿胀等过敏反应以及睾丸疼痛。
(2)严重的不良反应有男性乳房肿瘤。
(1)对本品过敏者。
(2)美国FDA妊娠用药安全性分级为口服给药X。
(3)妇女或儿童。
(1)血清前列腺特异性抗原(PSA)浓度与患者年龄和前列腺体积有关,而前列腺体积又与患者年龄有关。当评价PSA测定结果意义时,应考虑接受本品治疗的因素。大多数患者用本品治疗的第一个月内PSA迅速降低,随后PSA水平稳定在一个新的基线上。治疗后基线约为治疗前基线值的一半,因此,对应用本品三个月以上患者所测定的PSA值应乘以2,才是血清中真实的PSA水平。这在鉴别前列腺癌时应特别注意,以此水平评价患者是否可能存在前列腺癌才不致延误病情。
(2)由于非那雄胺起效慢,用药3个月后才会发挥满意疗效,因此,目前临床通常的治疗策略是在开始前列腺增生药物治疗时,非那雄胺和α受体拮抗药联合应用,以迅速改善患者排尿不畅的症状。
(3)当患者的性伴侣怀孕或可能怀孕时,患者需避免其性伴侣接触其精液。
(4)肝功能异常或尿道梗阻患者慎用。
利托那韦可增加本药的血药浓度,因而非那雄胺与利托那韦应谨慎合用。可能的作用机制:利托那韦属于蛋白酶抑制药,利托那韦与数种细胞色素P450同工酶具有高亲和力,故可能会与许多药物发生相互作用。利托那韦能抑制CYP3A4介导的非那雄胺的代谢,导致非那雄胺血浆浓度升高,药理作用或
不良反应可能增加。应注意监测非那雄胺药效增加的迹象。
非那雄胺片:(1)1mg;(2)5mg。
非那雄胺胶囊:5mg。
(1) 取本品约20mg,加氢氧化钠0.1g,置试管中,混匀,加热至熔化,产生的气体能使湿润的红色石蕊试纸变蓝。
(2) 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3) 本品的红外光吸收图谱应与对照的图谱(光谱集793图)一致(如不一致,则取本品与非那雄胺对照品,分别加甲醇溶解后蒸干,残渣依法测定,两者的红外光吸收图谱应一致)。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品约25mg,置25ml量瓶中,加流动相使溶解并稀释至刻度,摇匀。
对照溶液 精密量取供试品溶液1ml,置200ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液 取非那雄胺与杂质Ⅰ适量,加流动相溶解并稀释制成每1ml中约含非那雄胺0.1mg与杂质Ⅰ0.01mg的溶液。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以乙腈-水(50:50)为流动相;检测波长为210nm;柱温为30℃;进样体积20μl。
系统适用性要求 系统适用性溶液色谱图中,理论板数按非那雄胺峰计算不低于3000,非那雄胺峰与杂质Ⅰ峰之间的分离度应符合要求。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分色谱峰保留时间的2倍。
限度 供试品溶液的色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(1.0%),小于对照溶液主峰面积0.1倍的峰忽略不计。
残留溶剂 照残留溶剂测定法(通则0861第三法)测定。
内标溶液 取正丁醇适量,加N-甲基吡咯烷酮稀释制成每1ml中含正丁醇约为0.2mg的溶液,摇匀。
供试品溶液 取本品约0.5g,精密称定,置10ml量瓶中,加内标溶液使溶解并稀释至刻度,摇匀。
对照品溶液 取环己烷、四氢呋喃、乙酸乙酯、甲醇、二氯甲烷、甲苯、二氧六环、吡啶、氯苯、N,N-二甲基甲酰胺与乙二醇各适量,精密称定,加内标溶液定量稀释制成每1ml中约含环己烷0.194mg、四氢呋喃0.036mg、乙酸乙酯0.25mg、甲醇0.15mg、二氯甲烷0.03mg、甲苯0.044mg、二氧六环0.019mg、吡啶0.01mg、氯苯0.018mg、N,N-二甲基甲酰胺0.044mg与乙二醇0.031mg的溶液。
色谱条件 以聚乙二醇为固定液的毛细管柱(HP-IN-NOWAX,1.0μm或极性相近)为色谱柱;程序升温,起始温度40℃,维持6分钟,以每分钟10℃的速率升温至220℃,维持2分钟;进样口温度220℃;检测器温度240℃;进样体积1μl。
系统适用性要求 对照品溶液色谱图中,各成分峰之间的分离度均应符合要求。
测定法 精密量取供试品溶液与对照品溶液,分别注入气相色谱仪,记录色谱图。
限度 按内标法以峰面积计算,环己烷、四氢呋喃、乙酸乙酯、甲醇、二氯甲烷、甲苯、二氧六环、吡啶、氯苯、N,N-二甲基甲酰胺与乙二醇的残留量均应符合规定。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
硒 取本品0.10g,依法检查(通则0804),应符合规定(0.005%)。
砷盐 取本品0.50g,加氢氧化钙0.5g,混匀,小火加热至炭化,550℃灰化,加盐酸5ml与水23ml,依法操作(通则0822),应符合规定(0.0004%)。
照高效液相色谱法(通则0512)测定。
供试品溶液 取本品约25mg,精密称定,置25ml量瓶中,加流动相适量使溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液 取非那雄胺对照品约25mg,精密称定,置25ml量瓶中,加流动相适量使溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液、色谱条件与系统适用性要求 见有关物质项下。
测定法 精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
5α-还原酶抑制剂。
遮光,密封保存。
杂质Ⅰ
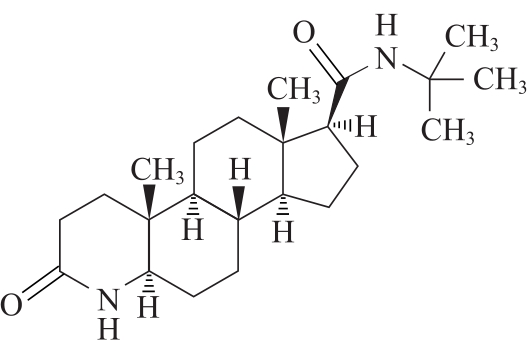
C23H28N2O2 374.57
N-叔丁基-3-氧代-4-氮杂-5α-雄甾烷-17β-甲酰胺
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
