登录/
注册
登录/
注册
盐酸奥昔布宁
Yansuan Aoxibuning
Oxybutynin Hydrochloride
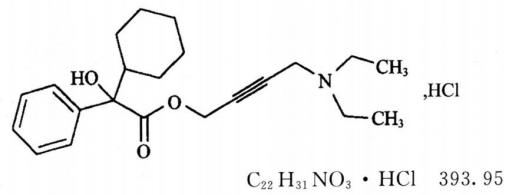
本品为α-环己基-α-羟基-苯乙酸-4-二乙氨基-2-丁炔酯盐酸盐。按干燥品计算,含C22H31NO3·HCl不得少于98.0%。
本品为白色结晶或结晶性粉末;无臭。
本品在甲醇或三氯甲烷中易溶,在水中溶解,在正己烷中几乎不溶;在冰醋酸中溶解。
熔点 本品的熔点(通则0612)为124~129℃。
用于无抑制性和反流性神经源性膀胱功能障碍患者与排尿有关的症状缓解,如尿急、尿频、尿失禁、夜尿和遗尿等。
口服 成人 一次 2.5~5 mg,一日2~3次;最大剂量为一次5mg,一日4次。或遵医嘱。
【儿科用法与用量】 口服 5岁以上儿童常用量,一次5mg,一日2次;最大剂量,一次5mg,一日3次。或遵医嘱。5岁以下儿童的临床数据不足,不推荐使用。
(1)药效学 本品具有较强的平滑肌解痉作用和抗胆碱作用,也有镇痛作用。可选择性作用于膀胱逼尿肌,降低膀胱内压,增加容量,减少不自主的膀胱收缩,而缓解尿急、尿频和尿失禁等。口服后起效时间为30~60分钟,3~6小时作用达高峰,解痉作用可持续6~10小时。
(2)药动学 口服吸收迅速完全,tmax约1小时,有首过消除,生物利用度仅6%。血浆蛋白结合率高,主要分布于脑、肺、肾和肝脏。在肝脏经CYP3A4代谢,原形药物和代谢产物经尿和粪便排泄。t1/2为2~3小时。
为改善口服奥昔布宁的不良反应,既往研制了奥昔布宁透皮控释贴片,该贴片直接通过皮肤吸收进入全身血液循环,不用经过胃肠道系统,可避免或减少奥昔布宁代谢产物所引起的不良反应如口干、便秘等。但该贴剂本身却带来了皮肤瘙痒等不良反应,致使临床应用受到限制。盐酸奥昔布宁透皮凝胶剂,既具备抗胆碱药物的治疗优势,又因本品能避开肝脏直接经皮吸收入血,从而能够避免或减少口干等不良反应的发生。2009年1月已通过美国FDA的新药上市批准应用于临床。国内尚无此药。
少数患者可出现口干、少汗、视物模糊、心悸、嗜睡、头晕、恶心、呕吐、便秘、腹泻、阳痿、抑制泌乳等抗胆碱能药物所产生的类似症状;个别患者可见过敏反应或药物特异性反应,如荨麻疹和其他皮肤症状。
(1)未控制的窄角型青光眼。
(2)胃潴留。
(3)尿潴留。
(4)对本品或其中任何成分过敏者。
(1)临床有明显的膀胱流出道梗阻者使用本药,有尿潴留的风险。
(2)肠张力缺乏或溃疡性结肠炎的患者使用本药,有胃肠蠕动下降的风险。
(3)胃肠道梗阻的患者使用本药,有胃潴留的风险。
(4)重症肌无力、老年和所有自主神经功能紊乱患者慎用。
(5)肝、肾疾病患者慎用。
(6)伴有食管裂孔疝的消化性食管炎患者或回肠和结肠造口术患者慎用。
(7)驾驶员、机器操作工、高空作业人员及从事危险工作的人员在使用本品时,应告知可能产生视物模糊或嗜睡等不良反应。
(8)伴有感染的患者,应合并使用相应的抗感染药物。
(9)甲状腺功能亢进症、冠心病、充血性心力衰竭、心律失常、高血压及前列腺肥大等患者使用本品后,可加重症状。
(10)哺乳期妇女使用对乳儿的危害不能排除。
(11)5岁以下儿童患者使用的安全性和有效性尚未建立。
(12)美国FDA妊娠期用药安全性分级为口服给药B。
(1)同时口服氯化钾固体剂型,可引起氯化钾在胃肠道内通过的速度减慢或迟滞,增加胃肠道损害的风险,属于禁忌。
(2)与其他抗胆碱能药合用会导致抗胆碱能作用异常增强。
(3)与中枢神经系统抑制药或乙醇合用,镇静作用增强。
(4)与CYP3A4抑制药(如咪唑类抗真菌药、大环内酯类抗生素)合用,本品血药浓度增加。
(5)与醋异丙嗪合用会导致毒性相加。可能的作用机制:奥昔布宁属于一种抗胆碱药物,能够抑制乙酰胆碱对毒蕈碱受体的激动作用。醋异丙嗪属于一种吩噻嗪类精神抑制药,主要用于缓解精神病症状,预防复发。合用时,应监测患者可能出现的相互作用的表现,必要时给予医学干预或调整治疗。处理措施:①谨慎合用;②监测患者的临床情况。
盐酸奥昔布宁片(胶囊):5mg。
盐酸奥昔布宁口服溶液:60ml:60mg。
盐酸奥昔布宁缓释片(胶囊):10mg。
(1)取本品约0.2g,加乙醇20ml与水5ml使溶解,加硫酸汞约30mg与0.5mol/L硫酸溶液10ml,搅拌使溶解,放冷,用2mol/L氢氧化钠溶液调节pH值至6.0,用乙醚20ml振摇提取,乙醚提取液置水浴上蒸干,取残渣置试管中,加乙醇3ml使溶解,加二硝基苯肼试液3ml,振摇,置水浴中煮沸1分钟,即显橙色。
(2)取本品适量,加流动相溶解并稀释制成每1ml中约含0.1mg的溶液,作为供试品溶液;另取盐酸奥昔布宁对照品适量,同法制备,作为对照品溶液。照有关物质项下的方法试验,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(3)本品的红外光吸收图谱应与对照的图谱(光谱集1032图)一致。
(4)本品显氯化物的鉴别反应(通则0301)。
旋光度 取本品,精密称定,加水溶解并定量稀释制成每1ml中含0.10g的溶液,依法测定(通则0621),旋光度为-0.10°至+0.10°。
有关物质 照高效液相色谱法(通则0512)测定。
供试品溶液 取本品,加流动相溶解并稀释制成每1ml中约含1mg的溶液。
对照溶液 精密量取供试品溶液1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀。
色谱条件 用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取磷酸二氢钾1.94g与磷酸氢二钾2.48g,加水1000ml使溶解,用1mol/L磷酸调节pH值至6.8)-甲醇(15∶85)为流动相;检测波长为220nm;进样体积10μl。
系统适用性要求 理论板数按奥昔布宁峰计算不低于2000,奥昔布宁峰与相邻杂质峰的分离度应符合要求。
测定法 精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度 供试品溶液色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液的主峰面积(1.0%)。
干燥失重 取本品,在105℃干燥至恒重,减失重量不得过3.0%(通则0831)。
炽灼残渣 取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属 取炽灼残渣项下遗留的残渣,依法检查(通则0821),含重金属不得过百万分之十。
含氯量 取本品约0.6g,精密称定,加水5ml与冰醋酸5ml使溶解,加甲醇50ml与曙红指示液5滴,用硝酸银滴定液(0.1mol/L)滴定至红色。每1ml硝酸银滴定液(0.1mol/L)相当于3.54mg的氯,按干燥品计算,含氯量应为8.0%~10.0%。
取本品约0.3g,精密称定,加无水冰醋酸20ml使溶解,加醋酐30ml,照电位滴定法(通则0701),用高氯酸滴定液(0.1mol/L)滴定,并将滴定的结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于39.40mg的C22H31NO3·HCl。
解痉药。
密封保存。
1、中华人民共和国药典:2020年版. 二部/国家药典委员会编. —北京:中国医药科技出版社,2020.5 ISBN 978-7-5214-1598-8
2、中华人民共和国药典临床用药须知:2015年版. 化学药和生物制品卷/国家药典委员会编.—北京:中国医药科技出版社,2017.9 ISBN 978-7-5067-9513-5
