登录/
注册
登录/
注册
7.1实验项目
7.1.1动物体重
7.1.2负重游泳实验
7.1.3血乳酸
7.1.4血清尿素
7.1.5肝糖原或肌糖原
7.2试验原则
7.2.1动物实验所列指标均为必做项目。
7.2.2实验前必须对同批受试样品进行违禁成分的检测。
7.2.3运动实验与生化指标检测相结合。
7.3结果判定
负重游泳实验结果阳性,血乳酸、血清尿素、肝糖原/肌糖原三项生化指标中任二项指标阳性,可判定该受试样品具有缓解体力疲劳的作用。
动物实验
1 负重游泳实验
1.1 检验原理
运动耐力的提高是抗疲劳能力加强最直接的表现,游泳时间的长短可以反应动物运动疲劳的程度。
1.2 仪器与器材
游泳箱(大小约 50cm×50cm×40cm),电子天平、铅皮。
1.3 实验方法
1.3.1 实验动物 推荐使用纯系小鼠,成年小鼠,体重 18-22g。
1.3.2 剂量分组及受试样品给予时间
实验设三个剂量组和一个阴性对照组,以人体推荐量的 10 倍为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。受试样品给予时间 30 天,必要时可延长至 45 天。
1.3.3 实验步骤
末次给予受试样品 30min 后(酒类样品测试当天可以不灌胃),将尾根部负荷 5%体重铅皮的小鼠置于游泳箱中游泳。水深不少于 30cm,水温 25℃±1.0℃,记录小鼠自游泳开始至死亡的时间,即小鼠负重游泳时间。
1.4 数据处理及结果判定
游泳时间为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
若受试样品组负重游泳时间明显长于对照组,且差异有显著性,可判定该实验结果阳性。
1.5 注意事项
1.5.1 每一游泳箱一次放入的小鼠不宜太多,否则互相挤靠,影响实验结果。
1.5.2 水温对小鼠的游泳时间有明显的影响,因此要求各组水温控制一致,每一批小鼠下水之前都应测量水温,水温以 25℃为宜,如果过低可能引起小鼠痉挛,影响实验结果,过高(30℃)则游泳时间太长不便于操作。
1.5.3 铅皮缠绕松紧应适宜。
1.5.4 观察者应在整个实验过程中使每只小鼠四肢保持运动。如果小鼠漂浮在水面四肢不动,可用木棒在其附近搅动。
1.5.5 不同批的小鼠因饲养环境、季节等原因的变化体质上会出现差异。因此受试样品组和对照组应采用同一批动物同时进行实验。
2 血清尿素测定
全自动生化仪测定和二乙酰—肟法任选一种。
2.1 全自动生化仪测定:按有关仪器说明书和试剂盒操作。
2.2 二乙酰—肟法
2.2.1 原理
样品中尿素在氯化高铁—磷酸溶液中与二乙酰—肟和硫氨脲共煮,形成一种红色的化合物 Diazine,其颜色的深浅与尿素含量成正比。与同样处理的尿素标准管比较,可求出尿素的含量。
2.2.2 仪器和试剂
2.2.2.1 721 分光光度计,10mL 带塞试管,1mL(或 1.5mL)塑料离心管,电炉,锅,灌胃针头。
2.2.2.2 尿素试剂盒(二乙酰-肟法):二乙酰-肟应用液、氯化铁-磷酸应用液、尿素标准液(200 mg/L)。
2.2.2.3 若无试剂盒,可自行配制试剂。试剂配制方法如下:
1g/L 二乙酰—肟溶液:取二乙酰—肟 1.0g,氨基硫脲(thiosemicarbazide)0.2g,氯化钠 4.5g,溶于蒸馏水并加至 1000mL。
33g/L 三氯化铁溶液:取三氯化铁 1.0g 溶于浓磷酸 20mL 中,加蒸馏水 10mL,摇匀。
酸溶液:取蒸馏水 800mL,慢慢加入浓硫酸 50mL,边加边摇;再加入 85%磷酸 50mL,摇匀。加入 33g/L三氯化铁溶液 1.5mL,加水至 1L。
10 mmol/L 尿素标准液(尿素 28.01mg/dL):精确称取尿素(AR)150.3mg 溶于 16 mmol/L 苯甲酸溶液并加至 250mL。
16 mmol/L 苯甲酸液:取苯甲酸 2.0g 溶于蒸馏水 1000mL 中,加浓硫酸 0.8mL。
2.2.3 实验方法
2.2.3.1 实验动物 成年小鼠或大鼠,小鼠体重 18-22g,Wistar 或 SD 大鼠体重 160-200g。推荐使用雄性小鼠。
2.2.3.2 剂量设计和分组 大鼠以人体推荐量的 5 倍为基本剂量。其余同 1.3.2。
2.2.3.3 实验步骤
2.2.3.3.1 高尿素模型的建立及标本制备:末次给受试样品 30min 后,在温度为 30℃的水中不负重游泳 90min,休息 60min 后采血。大鼠采尾血,小鼠拔眼球采全血约 0.5mL(不加抗凝剂)。置 4℃冰箱约 3h,血凝固后2000r/min 离心 15min,取血清备用。血清中的尿素在室温下可稳定 24h,在 4-6℃可稳定 7 天以上。用二乙酰—肟法测定。
2.2.3.3.2 试剂盒操作步骤(本推荐使用的试剂盒适用于手工操作)
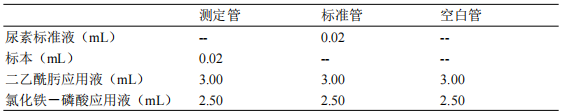
充分混匀,置沸水浴中煮沸 10 分钟,再于冷水中冷却。在 520nm 波长处(或绿色滤光板),以蒸馏水调零,测定各管吸光度值。
计算公式:


标准液浓度值为 200mg/L。
2.2.3.3.3 自行配制试剂按下表操作:
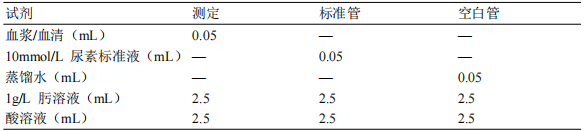
充分混匀,置沸水浴准确 15min,立即用自来水冷却。用波长 520nm,以空白管调零,读取各管吸光度(A 值)。
尿素含量计算
尿素(mmol/L)=Au×10/As
尿素(mg/dL)=Au×28.01/As
式中 Au-测定管吸光度
As-标准管吸光度
2.3 数据处理及结果判定
尿素数据为计量资料,可用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
若受试样品组血清尿素低于对照组,且差异有显著性,可判定该实验结果阳性。
2.4 注意事项
2.4.1 为避免色度转移,应在标本加入后 30min 内读出吸光度值。
2.4.2 一般标本测定管反应后应澄清,严重脂血可制备血滤液重新测定。
2.4.3 煮沸时间应准确。
3 肝糖原测定:蒽酮法。
3.1 检测原理
蒽酮可与游离糖或多糖起反应,反应后溶液呈蓝绿色,于 620nm 处有最大吸收。测定其光密度,可以确定糖原的含量。
3.2 仪器和试剂
3.2.1 仪器:721 型分光光度计,离心机,扭力天平,匀浆器,振荡器,移液泵,沸水浴,灌胃针头,手术器械,玻璃漏斗,加样器,2mL、5mL、10mL 吸量管,20mL 带塞刻度试管,10mL 带塞离心管。
3.2.2 试剂:5%三氯醋酸(用蒸馏水配)(TCA),葡萄糖标准液,浓硫酸(AR),蒽酮试剂。
蒽酮试剂:溶液中含 0.05%的蒽酮,1%的硫脲,用 72%的 H 2SO4配制。配制方法如下:
①72%H2SO4 配制:烧杯中加入 280mL 蒸馏水,再加入浓硫酸 720mL(比重 1.84)。
②蒽酮试剂配法:当 H2SO4 温度降至 80-90℃时放入 500mg 蒽酮,10g 硫脲,适当摇动烧杯混匀。冷却后存放于冰箱中,可保存两周。
3.3 实验方法
3.3.1 实验动物 同 2.2.3.1
3.3.2 剂量设计和分组
大鼠剂量以人体推荐食用量扩大 5 倍作为基本剂量,其余同 1.3.2。
3.3.3 实验步骤
末次给样后30min处死动物,取肝脏经生理盐水漂洗后用滤纸吸干,精确称取肝脏100mg,加入8mL TCA,每管匀浆 1min,将匀浆液倒入离心管,以 3000r/min 离心 15min,将上清液转移至另一试管内。
取 1mL 上清液放入 10mL 离心管中(每样品可做两平行管以保证获得可靠结果),每管加入 95%的乙醇4mL,充分混匀至两种液体间不留有界面。用干净塞子塞上,室温下竖立放置过夜(也可选用将试管放在 37 -40℃水浴 3h)。沉淀完全后,将试管于 3000r/min 离心 15min。小心倒掉上清液并使试管倒立放置 10min。
用 2mL 蒸馏水溶解糖原,加水时将管壁的糖原洗下。如管底的糖原不立即溶解,振荡管子直到完全溶解。
制作试剂空白和标准管:
试剂空白:吸 2mL 蒸馏水到干净离心管。
标准管:吸 0.5mL 葡萄糖标准液(含 100mg/dL 葡萄糖)和 1.5mL 蒸馏水放入同样的管子。
此时将 10mL 蒽酮试剂用力加入各管,液流(蒽酮试剂)直接进入管子中央,保证充分混合好。从管子中注入蒽酮试剂时起,将管子放在冷水龙头下冲凉。在所有管子都达到凉水温度后,将其浸于沸水浴(水浴深度略高于管子液面)15min,然后移到冷水浴。将管内液体移入比色管,在 620nm 波长下,用试剂空白管调零后测定吸光度。根据所称取的肝脏重量换算成肝糖原含量(以 mg/g 肝表示),并进行统计分析。
3.3.3.3 糖原含量计算:
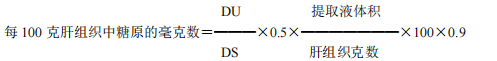
DU:样品管吸光度
DS:标准管吸光度
0.5:为 0.5mL 葡萄糖标准液液中的葡萄糖含量。
0.9:为将葡萄糖换算成糖原的系数。
提取液体积:为 8mL
肝组织克数:为 0.1g
3.4 数据处理及结果判定
肝糖原数据为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
若受试样品组肝糖原含量明显高于对照组,且差异有显著性,可判定该实验结果阳性。
3.5 注意事项
3.5.1 测定的实验方法均为定量要求,因此所有取样加试剂均需准确。
3.5.2 糖原测定中冷却、加热时间与氧化还原作用有关,因此时间要控制准确。
3.5.3 蒽酮显色剂不稳定,以临用时配制为宜,注意避免采用绒布或被污染的糖类进入蒽酮反应。
4 血乳酸测定
4.1 原理
4.1.1 自配试剂测定方法:
在铜离子催化下,乳酸与浓硫酸在沸水中反应,乳酸转化为乙醛,乙醛与对羟基联苯反应产生紫色化合物,在波长 560nm 处有强烈的光吸收,故可进行定量测定。
4.1.2 乳酸盐测定仪测定方法:
检测探头上装有一片三层的膜,其中间层为固定的乳酸盐氧化酶。表面被膜覆盖的探头位于充满缓冲液的样品室内,当样品被注入样品室后,部分底物会渗进膜中;当它们接触到固定酶(乳酸盐氧化酶)时便迅速被氧化,产生过氧化氢。过氧化氢(H2O2)继而在铂阳极上被氧化产生电子。当过氧化氢生成率和离开固定膜层的速率达到稳定时便可得到一个动态平衡状态,可用稳态响应表示。电子流与稳态过氧化氢浓度成线性比例,因此与乳酸盐浓度成正比。
4.2 仪器与试剂
4.2.1 仪器:
4.2.1.1 血乳酸测定—自配试剂测定方法:微量吸管,恒温水浴锅,电热水箱,分光光度计。
4.2.1.2 乳酸仪测定方法:乳酸仪、加样器、振荡器。
4.2.2 试剂
4.2.2.1 自配试剂测定方法:
4%CuSO4、浓硫酸(AR)、1%NaF 溶液。
蛋白沉淀剂:按体积分别取一份 10%的钨酸钠,一份 1/3 mol/L 硫酸,再与 28 份蒸馏水混合即成。
沉淀剂-NaF 混合液:按体积分别取 3 份沉淀剂,1 份 1%NaF 混合即成。
1.5% 对羟基联苯溶液:称取 1.5g 对羟基联苯溶于 100mL 热的 0.5% NaOH 中(可保存半年)。
乳酸标准储备液(1g/L):称取 106.6mg 乳酸锂或 171mg 乳酸钙,以 10%的三氯乙酸定容至 100mL(室温下可保存半年)。
乳酸标准应用液(0.01g/L):准确吸取 1.0mL 乳酸标准储备液稀释定容至 100mL,此液要求现用现配。
4.2.2.2 乳酸仪测定方法:破膜液、磷酸盐缓冲液、氯化钠。
4.3 实验方法
4.3.1 实验动物 同 2.2.3.1
4.3.2 剂量设计和分组:大鼠以人体每日每公斤体重推荐量的 5 倍为基本剂量,其余同 1.3.2。
4.3.3 实验步骤
4.3.3.1 高血乳酸模型的制作及血标本制备: 末次给样 30min 后采血,然后不负重在温度为 30℃的水中游泳10min 后停止。乳酸仪测定方法:在游泳前各采血 20μL 加入 40μL 破膜液中,立即充分振荡破碎细胞;游泳后立即采血 20μL 加入 40μL 破膜液中振荡;休息 20min 后再各采血 20μL 加入 40μL 破膜液中振荡,用乳酸仪测定。自配试剂测定方法同样在上述三个时间点各采血 20μL 按以下步骤操作。大鼠采尾血,小鼠用毛细管从内眦采血。
4.3.3.2 测定步骤
4.3.3.2.1 自配试剂测定:于 5mL 试管中加入 0.48mL 1% NaF 溶液,准确吸取全血 20μL 加入试管底部。用试管上清液清洗微量吸管数次,再加入 1.5mL 蛋白沉淀剂,振荡混匀,于 3000r/min 离心 10min,取上清液,按下表操作。
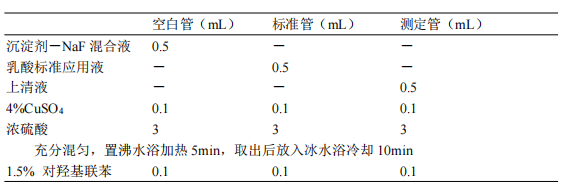
上述步骤完成后,摇匀,置30℃水浴30min(每隔10min振摇一次)。取出后放入沸水浴中加热90s,取出冷却至室温,在波长560nm处用5mm光径比色皿比色,空白管调零。
4.3.3.2.2乳酸盐测定仪测定方法:按仪器操作说明书操作。
4.3.3.3血乳酸含量计算
4.3.3.3.1 自配试剂测定方法: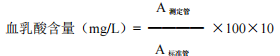
4.3.3.3.2 乳酸盐测定仪测定方法:直接从乳酸仪上读数,实际值=测得值×3(20μL 样品加入 40μL 破膜液中,已稀释了 3 倍)。
4.4 数据处理及结果判定
乳酸测定数据为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F 值,F 值<F0.05,结论:各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
实验结果判定:以三个时间点血乳酸曲线下面积来判断。任一试验组的面积小于对照组,且差异有显著性,可判定该实验结果阳性。
血乳酸曲线下面积计算方法:
血乳酸曲线下面积=1/2×(游泳前血乳酸值+游泳后 0min 的血乳酸值)×10+1/2×(游泳后 0min 的血乳酸值+游泳后休息 20min 的血乳酸值)×20 =5×(游泳前血乳酸值+3×游泳后 0min 的血乳酸值+2×游泳后休息 20min 的血乳酸值)。
5 结果判定
负重游泳实验结果阳性,且血乳酸、血清尿素、肝糖原/肌糖原三项生化指标中任二项指标阳性,可判定该受试样品具有缓解体力疲劳的作用。
