登录/
注册
登录/
注册
22.1 试验项目
动物实验分为方案一(四氯化碳肝损伤模型)和方案二(酒精肝损伤模型)两种。
22.1.1 方案一(四氯化碳肝损伤模型)
22.1.1.1 体重
22.1.1.2 谷丙转氨酶(ALT)
22.1.1.3 谷草转氨酶(AST)
22.1.1.4 肝组织病理学检查
22.1.2 方案二(酒精肝损伤模型)
22.1.2.1 体重
22.1.2.2 丙二醛(MDA)
22.1.2.3 还原型谷胱甘肽(GSH)
22.1.2.4 甘油三酯(TG)
22.1.2.5 肝组织病理学检查
22.2 试验原则
22.2.1 所列指标均为必做项目。
22.2.2 根据受试样品作用原理的不同,方案一和方案二任选其一进行动物实验。
22.3 结果判定
方案一(四氯化碳肝损伤模型):病理结果阳性,谷丙转氨酶和谷草转氨酶二指标中任一项指标阳性可判定该受试样品具有对化学性肝损伤有辅助保护作用功能作用。
方案二(酒精肝损伤模型):①肝脏MDA、GSH、TG三项指标结果阳性,可判定该受试样品对乙醇引起的肝损伤有辅助保护功能,②肝脏MDA、GSH、TG三指标中任二项指标阳性,且肝脏病理结果阳性,可判定该受试样品具有对乙醇引起的肝损伤有辅助保护作用功能的作用。
1 方案一:四氯化碳肝损伤模型
1.1 原理
四氯化碳(CCl4)受到肝微粒体酶活化成为三氯甲烷自由基(CCl3•)与蛋白质共价结合导致蛋白合成障碍、脂质分解代谢紊乱,引起肝细胞内甘油三酯(TG)蓄积。CCl3•也能迅速与O2结合转化为过氧化三氯甲烷自由基(CCl3O2•)导致脂质过氧化,从而引起细胞膜的变性损伤,致使酶渗漏以及各种类型的细胞病变,甚至坏死。
1.2 实验动物
成年大鼠或小鼠,单一性别,大鼠(180-220克),每组8-12只,小鼠(18-22克),每组10-15只。
1.3 实验方法和步骤
1.3.1 剂量分组及受试样品给予时间
实验设三个剂量组、一个空白对照组和一个模型对照组,以人体推荐量的10倍(小鼠)或5倍(大鼠)为其中的一个剂量组,另设两个剂量组。用CCl4(分析纯)造成肝损伤模型,造模方式可以灌胃或腹腔注射。小鼠CCl4灌胃浓度为1%,以食用植物油稀释,灌胃量5mL/kgBW(折合CCl4的剂量为80mg/kg·BW),大鼠CCl4灌胃浓度为2-3%,灌胃量5mL/kgBW(折合CCl4的剂量为160-240mg/kgBW)。必要时设阳性对照组和溶剂对照组。受试样品给予时间30天,必要时可延长至45天。
1.3.2 给予受试样品的途径
经口灌胃给予受试样品,无法灌胃时将受试样品掺入饲料或饮水亦可,并记录每只动物的饲料摄入量或饮水量。
1.3.3 实验步骤
受试组每日经口灌胃给予受试样品,空白对照组和模型对照组给予蒸馏水。将动物每周称重两次,以调整受试样品剂量。于实验第30天将各组动物隔夜禁食16小时,模型组及各样品组一次灌胃给予CCl4,空白对照组给食用植物油,受试组继续给予受试样品至实验结束(与CCl4灌胃间隔4小时以上)。给予CCl4后,根据实际情况于24或48小时处死动物,取血分离血清,测定ALT、AST,并取肝脏进行病理组织学检测。
1.3.4 检测指标
血清谷丙转氨酶(ALT),谷草转氨酶(AST),肝脏病理组织学检查
1.4 血清谷丙转氨酶(ALT),谷草转氨酶(AST)的测定
1.4.1 测定方法:可选用全自动生化分析仪或赖氏法(试剂盒)测定。
1.4.2 数据处理和结果判定
采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计
受试样品组的 ALT、AST 与模型对照组比较,差异有显著性,可分别判定 ALT、AST 结果阳性。
1.5 肝脏病理组织学变化、诊断标准和结果判定
1.5.1 实验材料:取大鼠肝脏左叶用 10%福尔马林固定,从肝左叶中部做横切面取材,常规病理制片(石蜡 包埋,H.E.染色)。
1.5.2 镜检:用 40 倍物镜观察整个组织切片并记录组织的病理变化。可见小叶中心性肝细胞的退行性病变和 少数细胞坏死。主要病变类型有肝细胞气球样变、脂肪变性、胞浆凝聚、肝细胞水样变性和细胞坏死等。
1.5.3 评分标准:
分别记录每个视野中的各种病变所占视野的面积,并累计所观察视野的病变总分。
肝细胞气球样变:(细胞肿大,胞浆残留少许。)

肝细胞脂肪变性:(肝细胞胞浆内出现界限清晰的脂滴空泡。)

胞浆凝聚:(胞浆嗜伊红增强)

水样变性:

肝细胞坏死:(胞浆嗜伊红变,凝固性坏死)

1.5.4 数据处理和病理结果判定
采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
1.5.4.1 受试样品任何一个剂量组与模型对照组之间,气球样变、脂肪变性、胞浆凝聚、水样变性或肝细胞坏死等肝细胞病变中,肝细胞坏死程度减轻,差异有显著性,而其它病变类型与模型对照组比较明显减轻或无明显差异,可判断动物实验病理结果阳性。
1.5.4.2 受试样品任何一个剂量组与模型对照组之间,气球样变、脂肪变性、胞浆凝聚、水样变性这四种肝细胞病变类型加重和减轻同时存在,差异有显著性,且肝细胞坏死程度减轻,差异有显著性,则可将其各种病理变化的得分相加,肝细胞坏死评分2倍计入,以总分进行统计分析,若差异有显著性,可判断动物实验病理结果阳性。
1.6 结果判断
在模型成立的前提下,ALT、AST两项血液生化指标中任何一项和病理结果为阳性,可判定该受试样品具有对化学性肝损伤有辅助保护作用功能作用。
2 方案二:酒精肝损伤模型
2.1 原理
机体大量摄入乙醇后,在乙醇脱氢酶的催化下大量脱氢氧化,使三羧循环障碍和脂肪酸氧化减弱而影响脂肪代谢,致使脂肪在肝细胞内沉积。同时乙醇能激活氧分子,产生氧自由基导致肝细胞膜的脂质过氧化及体内还原型谷胱甘肽的耗竭。
2.2 实验动物
成年小鼠或大鼠,单一性别,大鼠(180-220克),每组8-12只,小鼠(18-22克),每组10-15只。
2.3 实验方法和步骤
2.3.1 剂量分组及受试样品给予时间
实验设三个剂量组和一个空白对照组和一个模型对照组,以人体推荐量的10倍(小鼠)或5倍(大鼠)为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。用无水乙醇(分析纯)造成肝损伤模型,无水乙醇浓度为50%(以蒸馏水稀释),小鼠灌胃量12-14mL/kgBW(折合乙醇的剂量为6000-7000mg/kgBW)。受试样品给予时间30天,必要时可延长至45天。
2.3.2 给予受试样品的途径
经口灌胃给予受试样品,无法灌胃时将受试样品掺入饲料或饮水亦可,并记录每只动物的饲料摄入量或饮水量。
2.3.3 实验步骤
每日经口灌胃给予受试样品,空白对照组和模型对照组给予蒸馏水。动物每周称重两次,按体重调整受试样品剂量。给予受试样品结束时将模型对照组及各样品组一次灌胃给予50%乙醇12mL/kgBW,空白对照组给蒸馏水,禁食16小时处死动物,进行各项指标的检测及病理组织学检查。
2.3.4 检测指标
肝组织中丙二醛(MDA) 还原型谷胱甘肽(GSH)
甘油三酯(TG)的含量。
2.4肝匀浆中过氧化脂质降解产物丙二醛(MDA)测定方法
2.4.1 原理
MDA(malondiadehycle)是细胞膜脂质过氧化的终产物之一,检测其含量可间接估计脂质过氧化的程度。MDA与硫代巴比妥酸在酸性条件下共热,形成粉红色复合物,吸收峰在535nm,据此可测得MDA的含量。
2.4.2 仪器与试剂
仪器721分光光度计、微量加样器、恒温水浴锅、普通离心机、混旋器、具塞离心管、组织匀浆器
试剂 0.2M乙酸盐缓冲液pH3.5
0.2M乙酸溶液185mL
0.2M乙酸钠溶液15mL
1mmol/L四乙氧基丙烷(贮备液,4℃保存3个月),临用前用水稀释成40nmol/mL
8.1%十二烷基硫酸钠SDS
0.8%硫代巴比妥酸TBA
0.2M磷酸盐缓冲液pH7.4
0.2M磷酸氢二钠 1920mL
0.2M磷酸二氢钾 480mL
2.4.3 实验步骤
2.4.3.1 样品制备
组织匀浆样品:取一定量的所需脏器,生理盐水冲洗、拭干、称重、剪碎,置匀浆器中,加入0.2M磷酸盐缓冲液,以20000r/min匀浆10s,间歇30s,反复进行3次,制成5%组织匀浆(W/V),3000r/min离心5~10min,取上清液待测。
2.4.3.2 样品测定
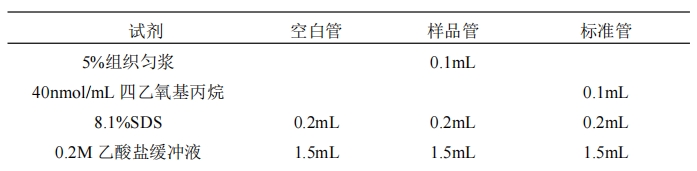

2.4.3.3 计算
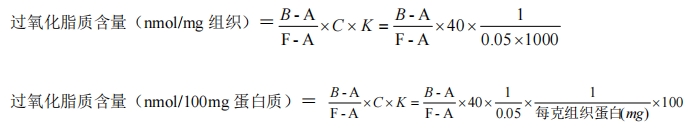
A:空白管吸光度
B:样品管吸光度
F:四乙氧基丙烷吸光度
C:四乙氧基丙烷浓度(40nmol/mL)
K:稀释倍数
2.4.3.4 数据处理及结果判定
数据采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论: 各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统 计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
结果判定
在模型成立的前提下,受试样品组的 MDA 含量与模型对照组比较,差异有显著性,判定该指标结果阳 性。
2.5 肝匀浆还原型谷胱甘肽(GSH)测定方法
2.5.1 原理
GSH 和 5,5'-二硫对硝基甲酸(DTNB)反应在 GSH-Px 催化下可生成黄色的 5-硫代 2-硝基甲酸阴离子, 于 423nm 波长有最大吸收峰,测定该离子浓度,即可计算 GSH 的含量。
2.5.2 试剂
2.5.2.1 0.9%生理盐水
2.5.2.2 4%磺基水杨酸溶液
2.5.2.3 1mol/L PBS 溶液(pH=8.0):
Na2HPO4 13.452g
KH2PO4 0.722g
加蒸馏水至 1000mL。
2.5.2.4 0.004%DTNB 溶液:称取 DTNB 40mg 溶于 1000mL 的 0.1mol/L PBS 溶液(pH=8.0)中。
2.5.2.5 叠氮纳缓冲液
NaN3 16.25 mg
EDTA-Na2 7.44 mg
Na2HPO4 1.732 g
NaH2PO4 1.076 g
加蒸馏水至 1000mL,用少量 HCl、NaOH 调 pH7.0,4℃保存。
2.5.2.6 标准溶液:称取还原型 GSH 15.4mg,加叠氮纳缓冲液至 50mL,终浓度为 1mmol/L,临用前配制。
2.5.3 方法
2.5.3.1 样品测定:取肝脏 0.5g 加生理盐水 5mL 充分研磨成细浆(10%肝匀浆),混匀后取浆液 0.5mL 加 4% 磺基水杨酸 0.5mL 混匀,室温下 3000rpm 离心 10 分钟,取上清液即为样品。
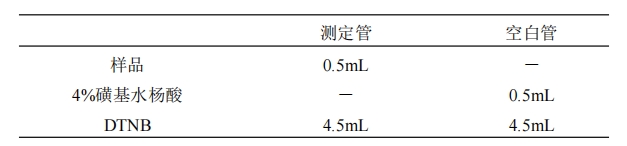
混匀,室温放置 10 分钟后,412nm 处测定吸光度。
2.5.3.2 标准曲线
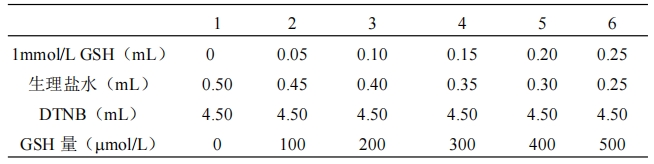
2.5.3.3 计算 样品 GSH 含量(μmol/g 肝组织)= 对应曲线浓度值(μmol/L)÷50g/L
2.5.4 数据处理和结果判定
数据采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论: 各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统 计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统 计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
结果判定
在模型成立的前提下,受试样品组的还原型 GSH 含量与模型对照组比较,差异有显著性,判定该指标 结果阳性。
2.6 肝匀浆中甘油三酯(TG)测定方法
2.6.1 测定方法:采用甘油三酯测定试剂盒(甘油磷酸氧化酶过氧化物酶法)测定 10%肝匀浆中的甘油三酯 含量。与血清甘油三酯测定方法相同,以等量 10%肝匀浆替代血清按操作说明书进行操作,测定结果以 mmol/g- 156 - 肝重表示。
2.6.2 数据处理和结果判定
数据采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论: 各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统 计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
结果判定
在模型成立的前提下,受试样品组的 TG 与模型对照组比较,差异有显著性,判定该指标结果阳性。
2.7 肝脏病理组织学变化、诊断标准和结果判定
2.7.1 实验材料:从肝左叶中部做横切面取材,冰冻切片,苏丹Ⅲ染色或油红 O 染色。
2.7.2 镜检:从肝脏的一端视野开始记录细胞的病理变化,用 40 倍物镜连续观察整个组织切片。主要观察脂 滴在肝脏的分布、范围和面积。
2.7.3 评分标准

2.7.4 数据处理和结果判定
采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
结果判定
在模型成立的前提下,模型对照组与受试样品任何一个剂量组之间,脂肪变性减轻,有统计学上的差异,可判断为阳性结果。
2.8 结果判定:满足任一条件,可判定受试样品具有对酒精性肝损伤有辅助保护作用。
2.8.1 肝脏MDA、还原型GSH和TG三项检测指标结果阳性。
2.8.2 肝脏MDA、还原型GSH和TG三项指标中任两项指标阳性和病理组织学检查结果阳性。
