登录/
注册
登录/
注册
20.1试验项目
20.1.1动物实验
分为方案一(胰岛损伤高血糖模型)和方案二(胰岛素抵抗糖/脂代谢紊乱模型)两种
20.1.1.1方案一(胰岛损伤高血糖模型)
20.1.1.1.1体重
20.1.1.1.2空腹血糖
20.1.1.1.3糖耐量
20.1.1.2方案二(胰岛素抵抗糖/脂代谢紊乱模型)
20.1.1.2.1体重
20.1.1.2.2空腹血糖
20.1.1.2.3糖耐量
20.1.1.2.4胰岛素
20.1.1.2.5总胆固醇
20.1.1.2.6甘油三酯
20.1.2人体试食试验
20.1.2.1空腹血糖
20.1.2.2餐后2小时血糖
20.1.2.3糖化血红蛋白(HbA1c)或糖化血清蛋白
20.1.2.4总胆固醇
20.1.2.5甘油三酯
20.2试验原则
20.2.1动物实验和人体试食试验所列指标均为必做项目。
20.2.2根据受试样品作用原理不同,方案一和方案二动物模型任选其一进行动物实验。
20.2.3除对高血糖模型动物进行所列指标的检测外,应进行受试样品对正常动物空腹血糖影响的观察。
20.2.4人体试食试验可在临床治疗的基础上进行。
20.2.5应对临床症状和体征进行观察。
20.2.6在进行人体试食试验时,应对受试样品的食用安全性作进一步的观察。
20.3结果判定
20.3.1动物实验:
方案一:空腹血糖和糖耐量二项指标中一项指标阳性,且对正常动物空腹血糖无影响,即可判定该受试样品有助于维持血糖健康水平动物实验结果阳性。
方案二:空腹血糖和糖耐量二项指标中一项指标阳性,血脂(总胆固醇、甘油三酯)无明显升高,且对正常动物空腹血糖无影响,即可判定该受试样品有助于维持血糖健康水平动物实验结果阳性。
20.3.2人体试食试验:空腹血糖、餐后2小时血糖、糖化血红蛋白(或糖化血清蛋白)、血脂四项指标均无显著升高,且空腹血糖、餐后2小时血糖两项指标中一项指标阳性,对机体健康无不利影响,可判定该受试样品具有有助于维持血糖健康水平的作用。
1 动物实验
1.1 实验动物
选用成年动物,选用小鼠(26 ±2g)或大鼠(180 ± 20g),单一性别,每组 10—15 只。
1.2 材料
1.2.1 试剂
四氧嘧啶(C4H2N2O4·H2O,分子量 160.08)或链脲佐菌素、地塞米松磷酸钠注射液、葡萄糖或医用淀粉、 血糖测定试纸或试剂盒,胰岛素、甘油三酯、总胆固醇测定试剂盒 。
1.2.2 高热能饲料
猪油 10%、蔗糖 15%、蛋黄粉 15%、酪蛋白 5%、胆固醇 1.2%、胆酸钠 0.2%、碳酸氢钙 0.6%、石粉 0.4%、 鼠维持饲料 52.6%。
1.2.3 仪器
血糖仪、全自动生化仪、可见光分光光度计、酶标仪、天平。
1.3 剂量分组及受试样品给予时间
实验设三个剂量组和一个模型对照组,以人体推荐量的 10 倍(小鼠)或 5 倍(大鼠)为其中的一个剂 量组,另设二个剂量组,高剂量一般不超过 30 倍,必要时设空白对照组。同时设给予受试样品高剂量的正 常动物组。受试样品给予时间 30 天,必要时可延长至 45 天。
1.4 实验方法
1.4.1 正常动物降糖实验
选健康成年动物按禁食 3-5 小时的血糖水平分组,随机选 1 个对照组和 1 个剂量组。对照组给予溶剂, 剂量组给予高剂量浓度受试样品,连续 30 天,测空腹血糖值(禁食同实验前),比较两组动物血糖值。
1.4.2 高血糖模型降糖实验
方案一
1.4.2.1 胰岛损伤高血糖模型
1.4.2.1.1 原理
四氧嘧啶(或链脲佐菌素)是一种 β细胞毒剂,可选择性地损伤多种动物的胰岛 β 细胞,造成胰岛素分 泌低下,引起实验性糖尿病。
1.4.2.1.2 造模方法
购入成年动物,适应 3—5 天后,随机取 15 只动物禁食 3-5 小时,测空腹血糖,作为该批次动物基础 血糖值。随后动物禁食 24 小时(自由饮水),注射四氧嘧啶(用前新鲜配制)造模,小鼠 45-50mg/kg BW.iv 或 125-130mg/kg BW.ip,大鼠 50-80mg/kg BW.iv 或 120-160mg/kg BW.ip。5-7 天后动物禁食 3-5 小时, 测血糖,血糖值 10-25mmol/L 为高血糖模型成功动物。
1.4.2.1.3 高血糖模型动物降糖实验
选高血糖模型动物按禁食 3-5 小时的血糖水平随机分组,设 1 个模型对照组和 3 个剂量组(组间差不 大于 1.1mmol/L)。剂量组给予不同浓度受试样品,模型对照组给予溶剂,连续 30 天,测空腹血糖值(禁食 同实验前),比较各组动物血糖值及血糖下降百分率。

1.4.2.1.4 高血糖模型动物糖耐量实验
剂量分组及受试样品给予时间同 1.4.2.1.3。各组动物禁食 3-5 小时,测定给葡萄糖或医用淀粉前(即 0 小时)血糖值,剂量组给予不同浓度受试样品,模型对照组给予同体积溶剂,15-20 分钟后各组经口给予葡 萄糖 2.0g/kg BW 或医用淀粉 3-5g/kg BW ,测定给葡萄糖后各组 0.5、2 小时的血糖值或给医用淀粉后 1、2 小时的血糖值,观察模型对照组与受试样品组给葡萄糖或医用淀粉后各时间点(0、0.5、2 小时)血糖值及 血糖曲线下面积的变化。

方案二
1.4.2.2 胰岛素抵抗糖/脂代谢紊乱模型(任选其一)
1.4.2.2.1 地塞米松诱导胰岛素抵抗糖\脂代谢紊乱模型
1.4.2.2.1.1 原理
糖皮质激素具有拮抗胰岛素生物效应的作用,可抑制靶组织对葡萄糖的摄取和利用,促进蛋白质和脂肪 的分解及糖异生作用,导致糖、脂代谢紊乱,胰岛素抵抗,诱发实验性糖尿病。
1.4.2.2.1.2 试验方法
购入健康雄性大鼠(150 20g),普通维持料适应饲养 3-5 天,禁食 3-4 小时,取尾血,测定空腹即 给葡萄糖前(0 小时)血糖值,给 2.5g/kg·BW 葡萄糖后测定 0.5、2 小时血糖值,作为该批次动物基础值。以 0、0.5 小时血糖水平分 5 个组,即 1 个空白对照组、1 个模型对照组和 3 个剂量组,每组 15 只。空白对照组 不作处理,3 个剂量组灌胃给予不同浓度受试样品,模型对照组给予同体积溶剂,连续 35 天。各组给予维持 饲料饲养,1 周后模型对照组和 3 个剂量组更换高热能饲料,喂饲 2 周后,模型对照组和 3 个剂量组在高热 能饲料基础上分别给予地塞米松 0.8mg/ kg BW 腹腔注射(0.008%地塞米松注射量 1ml/100g 体重),每日 1 次, 连续 10-12 天。试验结束,各组动物禁食 3-4 小时,检测空腹血糖、糖耐量、血清胰岛素及胆固醇、甘油 三脂水平。
1.4.2.2.1.3 观察指标
1.4.2.2.1.3.1 空腹血糖、糖耐量
各组动物禁食 3-4 小时,测定空腹血糖即给葡萄糖前(0 小时)血糖值,剂量组给予不同浓度受试样品, 模型对照组给予同体积溶剂,空白对照组不作处理,15-20 分钟后各组经口给予葡萄糖 2.5g/kg BW,测定给 葡萄糖后各组 0.5、2 小时的血糖值,若模型对照组 0.5 小时血糖值≥10mmol/L,或模型对照组 0.5 小时、2 小时任一时间点血糖升高或血糖曲线下面积升高,与空白对照组比较,差异有显著性,判定模型糖代谢紊乱成立,在此基础上,观察模型对照组与受试样品组空腹血糖、给葡萄糖后(0.5、2 小时)血糖及 0、0.5、2 小时血糖曲线下面积的变化。

1.4.2.2.1.3.2 胆固醇、甘油三脂
各组动物禁食 3-4 小时,检测血清胆固醇、甘油三脂,若模型对照组血清胆固醇或甘油三酯明显升高, 与空白对照组比较,差异有显著性,判定模型脂代谢紊乱成立,在此基础上,观察模型对照组与受试样品组 血脂变化。
1.4.2.2.1.3.3 胰岛素
各组动物禁食 3-4 小时,检测血清胰岛素,模型对照组与空白对照组比较胰岛素抵抗指数无明显下降, 且动物糖/脂代谢紊乱成立,判定胰岛素抵抗糖\脂代谢紊乱模型成功。观察模型对照组与受试样品组胰岛素 抵抗情况。
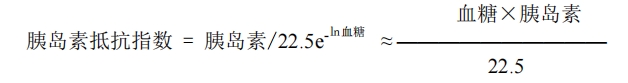
1.4.2.2.2 四氧嘧啶诱导胰岛素抵抗糖/脂代谢紊乱模型
1.4.2.2.2.1 原理
高热能饲料喂饲基础上,辅以小剂量四氧嘧啶(C4H2N2O4·H2O,分子量 160.08),造成糖/脂代谢紊乱, 胰岛素抵抗,诱发实验性糖尿病。
1.4.2.2.2.2 造模方法
购入健康雄性大鼠(150±20g),普通维持料适应饲养 3-5 天,禁食 3-4 小时,取尾血,测定给葡萄 糖前(即 0 小时)血糖值,给 2.5g/ kg BW 葡萄糖后 0.5、2 小时血糖值,作为该批次动物基础值。以 0、0.5 小时血糖水平分 5 个组,即 1 个空白对照组、1 个模型对照组和 3 个剂量组,每组 15 只。空白对照组不作处 理,3 个剂量组灌胃给予不同浓度受试样品,模型对照组给予同体积溶剂,连续 33 天。各组给予维持料饲养 1 周后模型对照组和 3 个剂量组更换高热能饲料,喂饲 3 周后,模型对照组和 3 个剂量禁食 24 小时(不禁水), 给予四氧嘧啶 103-105mg/kg BW 腹腔注射,注射量 1ml/100g 体重。注射后继续给予高热能饲料喂饲 3-5 天。试验结束,各组动物禁食 3-4 小时,检测空腹血糖、糖耐量、血清胰岛素及胆固醇、甘油三脂水平。
1.4.2.2.2.3 观察指标
1.4.2.2.2.3.1 空腹血糖、糖耐量
各组动物禁食 3-4 小时,测定空腹血糖即给葡萄糖前(0 小时)血糖值,剂量组给予不同浓度受试样品, 模型对照组给予同体积溶剂,空白对照组不作处理,15-20 分钟后各组经口给予葡萄糖 2.5g/kg BW,测定给 葡萄糖后各组 0.5、2 小时的血糖值,若模型对照组 0.5 小时血糖值≥10mmol/L,或模型对照组 0.5 小时、2 小时任一时间点血糖升高或血糖曲线下面积升高,与空白对照组比较,差异有显著性,判定模型糖代谢紊乱成立,在此基础上,观察模型对照组与受试样品组空腹血糖、给葡萄糖后(0.5、2 小时)血糖及 0、0.5、2 小时血糖曲线下面积的变化。

1.4.2.2.2.3.2 胆固醇、甘油三脂
各组动物禁食 3-4 小时,检测血清胆固醇、甘油三脂,若模型对照组血清胆固醇或甘油三酯明显升高, 与空白对照组比较,差异有显著性,判定模型脂代谢紊乱成立,在此基础上,观察模型对照组与受试样品组 血脂变化。
1.4.2.2.2.3.3 胰岛素
各组动物禁食 3-4 小时,检测血清胰岛素,模型对照组与空白对照组比较胰岛素抵抗指数无明显下降, 且动物糖/脂代谢紊乱成立,判定胰岛素抵抗糖\脂代谢紊乱模型成功。观察模型对照组与受试样品组胰岛素 抵抗情况。
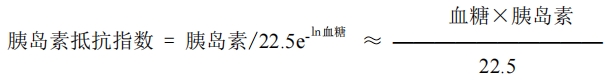
1.5 数据处理及结果判定
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算 F 值,F 值<F0.05,结论: 各组均数间差异无显著性;F 值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统 计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统 计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
1.5.1 指标判定
1.5.1.1 正常动物降糖试验
血糖指标:空腹血糖受试样品剂量组与对照组比较无统计学意义,判定对正常动物血糖无影响。
1.5.1.2 高血糖模型降糖试验
空腹血糖指标:模型成立的前提下,受试样品剂量组与模型对照组比较,空腹血糖下降或血糖下降百分 率升高有统计学意义,判定该受试样品空腹血糖指标结果阳性。
糖耐量指标:模型成立的前提下,受试样品剂量组与模型对照组比较,在给葡萄糖或医用淀粉后 0.5、2 小时任一时间点血糖下降(或血糖下降百分率升高)有统计学意义,或 0、0.5、2 小时血糖曲线下面积降低 有统计学意义,判定该受试样品糖耐量指标结果阳性。
血脂指标:模型成立的前提下,受试样品剂量组与模型对照组比较,血清胆固醇或甘油三酯下降有统计 学意义,可判定该受试样品降血脂指标阳性。
1.5.2 结果判定
方案一:空腹血糖和糖耐量二项指标中一项指标阳性,且对正常动物空腹血糖无影响,即可判定该受试 样品有助于维持血糖健康水平动物实验结果阳性。
方案二:空腹血糖和糖耐量二项指标中一项指标阳性,且血脂(总胆固醇、甘油三酯)无明显升高,对 正常动物空腹血糖无影响,即可判定该受试样品有助于维持血糖健康水平动物实验结果阳性。
1.6 注意事项
1.6.1 为了使实验动物糖代谢功能状态尽量保持一致,也为了准确地按体重计算受试样品的用量,实验前动 物应严格禁食 16h(不禁水),实验前后禁食条件应一致,鼠类在禁食的同时应更换衬垫物。
1.6.2 如用血清样品进行测定,应于取血后 30 分钟内分离血清,分离后血清的含糖量在 6 小时内不变。用血 清制备的无蛋白血滤液可保存 48 小时以上。
1.6.3 高浓度的还原性物质如 Vit C 亦能与色素原竞争游离氧,干扰反应,使结果偏低。
1.6.4 血红蛋白能使过氧化氢过早分解,亦干扰反应,致使测得血糖值偏低。故对已溶血的全血或血清必须 制备无蛋白滤液后,再进行测定。
1.7 血糖测定方法
用试纸或试剂盒,按说明书操作;若自行配制试剂,按下列方法操作:
1.7.1 原理
葡萄糖氧化酶是一种需氧脱氢酶,能催化葡萄糖生成葡萄糖酸和过氧化氢,后者在过氧化物酶作用下放 出氧,使 4-氨基安替比林与酚氧化缩合,生成红色醌类化合物,可在波长 505nm 比色测定。

1.7.2 试剂配制
磷酸盐缓冲液(0.2mol/L,pH7.0):0.2mol/L Na2HPO461mL,0.2mol/L KH2PO439mL 混合即可。
酶试剂:葡萄糖氧化酶 400u,过氧化物酶 0.6mg,4-氨基安替比林 10mg,叠氮钠 100mg,加磷酸盐缓冲 液至 100mL,pH 调至 7。冰箱存放至少可稳定 2 个月。
酚试剂:酚 100mg 溶于 100mL 蒸馏水中。
酶混合试剂:取等量酶试剂和酚试剂混合。在冰箱中可存放 1 个月。
葡萄糖标准液储存液:无水 D-葡萄糖(A.R.)在烤箱中 80℃烤 4 小时,冷却后,存放于干燥器中至恒重。 精确称取 2g 以 0.25%苯甲酸溶液溶解并移入 100mL 容量瓶中,再用苯甲酸溶液稀释至 100mL。
应用液:在 100mL 容量瓶中准确加入储存液 5mL,再用 0.25%苯甲酸溶液稀释至 100mL,即 1mg/mL 应用液。
蛋白沉淀剂:溶解磷酸氢二钠 10g、钨酸钠 10g、氯化钠 9g 于 800mL 蒸馏水中,加入 1mol/L 盐酸 125mL, 并用蒸馏水稀释至 1000mL。
1.7.3 操作步骤 取蛋白沉淀剂 1mL 加入血浆(血清)50μL 混匀。室温放置 7 分钟后,离心,取上清液(无蛋白血滤液) 测定。葡萄糖标准应用液亦进行同样处理。
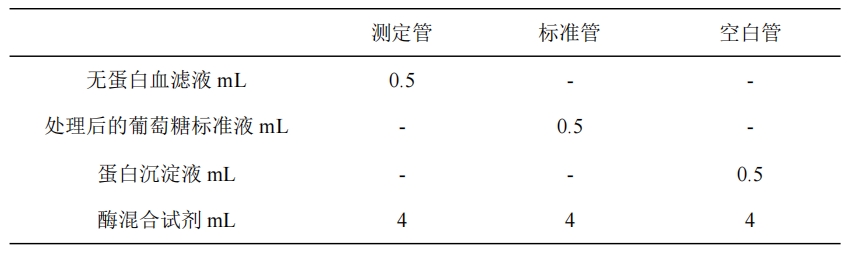
1.7.4 结果计算

2 人体试食试验
2.1 试验设计
试验采用随机分组,组间对照设计。
2.2 受试产品
受试产品必须是具有定型包装、标明服用方法和服用量的定型产品;安慰剂除功效成分外,在剂型、口 感、外观和包装上与受试产品保持一致。
2.3 受试者选择
2.3.1 纳入标准
选择空腹血糖 5.6-7mmol/L(100-126mg/dL)或餐后 2 小时血糖 7.8-11.1mmol/L(140-200mg/dL) 的糖调节受损(IGR)人群。
2.3.2 排除标准
2.3.2.1 糖尿病病人。
2.3.2.2 年龄在 18 岁以下或 65 岁以上,妊娠或哺乳期妇女,对受试样品过敏者。
2.3.2.3 有心、肝、肾等主要脏器并发症,或合并有其它严重疾病,精神病患者,服用糖皮质激素或其它影响 血糖药物者。
2.3.2.4 不能配合饮食控制而影响观察结果者。
2.3.2.5 近 3 个月内有糖尿病酮症、酸中毒以及感染者。
2.3.2.6 短期内服用与受试功能有关的物品,影响到对结果的判断者。
2.3.2.7 凡不符合纳入标准,未按规定服用受试样品,或资料不全影响观察结果者。
2.4 受试者分组
采用组间对照设计。根据随机盲法的要求进行分组。按受试者的糖化血红蛋白或糖化血清蛋白及血糖水 平随机分为试食组和对照组,尽可能考虑影响结果的主要因素进行均衡性检验,以保证组间的可比性。每组 受试者不少于 50 例。
2.5 试验方法
试验前对每一位受试者按性别、年龄、不同劳动强度、理想体重参照原来生活习惯规定相应的饮食,试 食期间坚持饮食控制,治疗糖尿病的药物种类和剂量不变。试食组在服药的基础上,按推荐服用方法和服用 量每日服用受试样品,对照组可服用安慰剂或采用空白对照。受试样品给予时间 2 个月,必要时可延长至 4 个月。
2.6 观察指标
2.6.1 安全性指标
2.6.1.1 一般状况体征 包括精神、睡眠、饮食、大小便、血压等
2.6.1.2 血、尿、便常规检查
2.6.1.3 肝、肾功能检查
2.6.1.4 胸片、心电图、腹部 B 超检查(仅试验前检查一次)
2.6.2 功效指标
2.6.2.1 症状观察
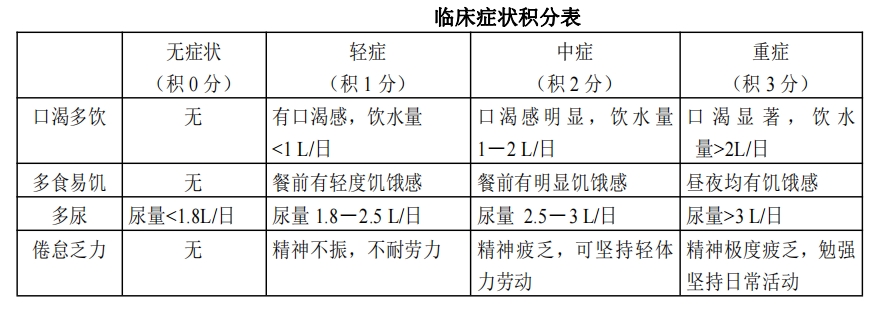
详细询问病史,了解患者饮食情况、用药情况、活动量,观察口渴多饮、多食易饥、倦怠乏力、多尿等 主要临床症状,按症状轻重积分,于试食前后统计积分值,并就其主要症状改善(改善 1 分为有效),观察 临床症状改善率。
2.6.2.2 空腹血糖
观察试食前后空腹血糖值、空腹血糖下降百分率、空腹血糖有效率。
2.6.2.3 餐后 2 小时血糖
观察试食前后食用 100g 精粉馒头后 2 小时血糖值、餐后 2 小时血糖下降百分率、餐后2小时血糖有效率。
2.6.2.4 糖化血红蛋白或糖化血清蛋白
观察试食前后糖化血红蛋白或糖化血清蛋白变化。
2.6.2.5 血脂
观察试食前后血清总胆固醇、血清甘油三酯水平。
2.7 注意
2.7.1 血清(浆)中的葡萄糖能与白蛋白及其他血清蛋白分子末端的氨基上发生非酶促糖化反应而形成高分子 酮胺结构。此酮胺结构能在碱性环境中与硝基四氮唑兰(NBT)发生还原反应生成蓝紫色物质,以1-脱氧-1-吗 啡啉果糖(DMF)作标准参照物在540nm波长处(530nm-550nm)进行比色测定,求得样本中果糖胺的浓度。参 考值为1.7mmol/L-2.5mmol/L。由于血清中白蛋白的半衰期约21d,所以糖化血清蛋白测定可反映患者过去2 -3周平均血糖水平。糖尿病患者的糖化血清蛋白的增加比糖化血红蛋白迅速,当血糖得到较好控制时,糖 化血清蛋白的下降也比糖化血红蛋白迅速,因此能较早地提供血糖控制信息。糖化血清蛋白更能灵敏地反映 近期糖尿病患者血糖的波动情况。它的敏感度高,特异性强。并不受年龄,饮食,药物,妊娠等因素的影响, 对血糖浓度的临时波动反应不敏感,是诊断糖尿病和较长时间血糖控制水平研究的良好指标。标本溶血对糖 化血清蛋白的测定结果有较大影响,血清中1 g/L的血红蛋白可导致GSP测定结果增高0.6 mmol/L左右。
2.7.2 糖化血红蛋白是经过缓慢的、不可逆的、非酶促反应而结合形成的产物,其浓度与红细胞寿命(平均 120 天)和该时期内血糖平均浓度有关,不受每天葡萄糖波动的影响,也不受运动或食物的影响,可反映患者抽血 前 2 个月-3 个月的平均血糖水平,是判断糖尿病长期控制的良好指标。糖化血红蛋白在健康人体内的波动 范围很小(0.1%-0.2%),正常值为 4%-6%。
2.8 数据处理和结果判定
凡自身对照资料可以采用配对 t 检验,两组均数比较采用成组 t 检验,后者需进行方差齐性检验,对非 正态分布或方差不齐的数据进行适当的变量转换,待满足正态方差齐后,用转换的数据进行 t 检验;若转换 数据仍不能满足正态方差齐要求,改用 t’检验或秩和检验;方差齐但变异系数太大(如 CV>50%)的资料应 用秩和检验。
2.8.1 血糖下降幅度

2.8.2 糖化血红蛋白或糖化血清蛋白下降幅度


2.8.3 功效判定标准
有效:⑴试验后空腹血糖恢复正常(≤5.6 mmol/L),或空腹血糖下降幅度≥10%
⑵试验后餐后 2 小时血糖恢复正常(≤7.8 mmol/L),或餐后 2 小时血糖下降幅度≥10% 无效:未达到有效标准。
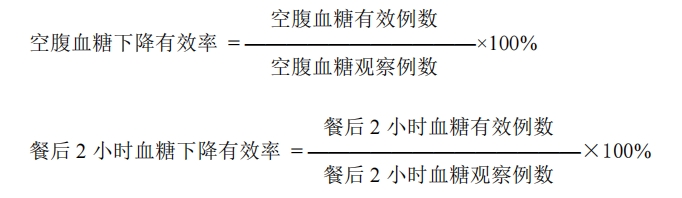
2.8.4 指标判定
2.8.4.1 空腹血糖:
①试验前后自身比较,空腹血糖下降差异有显著性,且试验后平均血糖恢复正常或下降幅度≥10%;② 试验后试食组空腹血糖值下降或空腹血糖下降幅度高于对照组,差异有显著性;③试验后试食组空腹血糖下 降有效率高于对照组,差异有显著性。满足上述 3 个条件,可判定该受试样品空腹血糖指标结果阳性。 2.8.4.2 餐后 2 小时血糖:
①试验前后自身比较,餐后 2 小时血糖下降差异有显著性,且试验后平均血糖恢复正常或下降幅度 ≥10%;②试验后试食组餐后 2 小时血糖值下降或餐后 2 小时血糖下降幅度高于对照组,差异有显著性;③ 试验后试食组餐后 2 小时血糖下降有效率高于对照组,差异有显著性。满足上述 3 个条件,可判定该受试样 品餐后 2 小时血糖指标结果阳性。
2.8.4.3 糖化血红蛋白(或糖化血清蛋白):
①试验前后自身比较,糖化血红蛋白(或糖化血清蛋白)下降差异有显著性;②试验后试食组糖化血红 蛋白(或糖化血清蛋白)值下降或糖化血红蛋白(或糖化血清蛋白)下降幅度高于对照组,差异有显著性。 满足上述 2 个条件,可判定该受试样品糖化血红蛋白(或糖化血清蛋白)指标结果阳性。
2.8.4.4 血清胆固醇:
①试验前后自身比较,血清胆固醇下降差异有显著性;②试验后试食组血清胆固醇下降与对照组比较, 差异有显著性。满足上述 2 个条件,可判定该受试样品血清胆固醇指标结果阳性。
2.8.4.5 血清甘油三酯:
①试验前后自身比较,血清甘油三酯下降差异有显著性;②试验后试食组血清甘油三酯下降与对照组比 较,差异有显著性。满足上述 2 个条件,可判定该受试样品血清甘油三酯指标结果阳性。
2.8.5 结果判定
空腹血糖、餐后 2 小时血糖、糖化血红蛋白(或糖化血清蛋白)、血脂四项指标均无明显升高,且空腹 血糖、餐后 2 小时血糖两项指标中一项指标阳性,对机体健康无不利影响,可判定该受试样品具有有助于维持血糖健康水平的作用。
