登录/
注册
登录/
注册
23.1 实验项目
23.1.1 体重
23.1.2 外周血白细胞计数
23.1.3 骨髓细胞DNA含量或骨髓有核细胞数
23.1.4 小鼠骨髓细胞微核实验
23.1.5 血/组织中超氧化物歧化酶活性实验
23.1.6 血清溶血素含量实验
23.2 实验原则
外周血白细胞计数、骨髓细胞DNA含量或骨髓有核细胞数、小鼠骨髓细胞微核实验、血/组织中超氧化物歧化酶活性实验、血清溶血素含量实验中任选择三项进行实验。
23.3 结果判定
在外周血白细胞计数、骨髓细胞DNA含量或骨髓有核细胞数、小鼠骨髓细胞微核、血/组织中超氧化物歧化酶活性、血清溶血素含量五项实验中任何二项实验结果阳性,可判定该受试样品具有对电离辐射危害有辅助保护作用功能的作用。
1 外周血白细胞计数实验
1.1 原理
外周血白细胞数减少是一次性全身γ射线照射引起辐射损伤的表现之一,在一定范围内,照射剂量与外周血中白细胞数成反比,恢复时间与外周血中白细胞数成正比,外周血中白细胞数可代表血液系统受损的状况。
1.2 仪器和试剂
20μL定量取血管、血球计数板、显微镜、1%盐酸等。
1.3 实验方法
1.3.1 实验动物:小鼠,18-22g,单一性别,每组10-15只。
1.3.2 剂量分组及受试样品给予时间
实验设三个剂量组和一个辐射模型对照组,以人体推荐量的10倍为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。受试样品于照射前给予14-30天,照射后仍然给予受试物,必要时可延长至45天。
1.3.3 实验步骤
受试样品组于照射前后经口连续给予受试样品,剂量组与辐射模型对照组均以同一剂量γ射线全身照射一次,照射剂量宜选择3Gy-5Gy。分别于照射前、照射后第3天、照射后第14天三次采末梢血20μL,加入0.38mL1%盐酸中,混匀后,加入血球计数板中,计算计数池中四个大方格中白细胞总数。

1.4 数据处理及结果判定
白细胞数为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
照射前的外周血白细胞计数,用于各组间白细胞数目的均衡性检验,剂量组与辐射模型对照组比较,差异无显著性,再进行照射及后续实验。
照射后3天辐射模型对照组的白细胞数分别与照射前进行自身比较,差异有显著性,则判定辐射损伤模型成立;任一时间点、任一剂量组与辐射模型对照组比较,白细胞总数增多,差异有显著性,则可判定该实验阳性。
2 骨髓细胞DNA含量或骨髓有核细胞数实验
2.1 原理
骨髓细胞DNA含量或骨髓有核细胞数降低是一次性全身γ射线照射引起辐射损伤的表现之一,在一定范围内,照射剂量与骨髓细胞DNA含量或骨髓有核细胞数成反比,恢复时间与骨髓细胞DNA含量或骨髓有
核细胞数成正比,骨髓细胞DNA含量或骨髓有核细胞数可代表造血系统受损的状况。
2.2 仪器和试剂
血球计数板、显微镜、注射器、手术器械、紫外分光光度计、Hank’s液等。
2.3 实验方法
2.3.1 实验动物:小鼠,18-22g,单一性别,每组10-15只。
2.3.2 剂量分组及受试样品给予时间
实验设三个剂量组和一个辐射模型对照组,以人体推荐量的10倍为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。受试样品于照射前给予14-30天,照射后仍然给予受试物,必要时可适当延长至45天。
2.3.3 实验步骤
受试样品组于照射前后经口连续给予受试样品,剂量组与辐射模型对照组均以同一剂量γ射线全身照射一次,照射剂量宜选择3Gy-5Gy。于照射后第3天,颈椎脱臼处死动物,剥离出股骨,用1mL注射器(6.5号针头)吸取一定体积的Hank’s液,冲出股骨中的全部骨髓细胞;最后,让细胞悬液通过4号针头的注射器,使细胞在悬液中充分分散。
镜下计数。计算每mL骨髓细胞悬液中的有核细胞数。
或用紫外分光光度计260nm处测定DNA含量。
2.4 数据处理及结果判定
骨髓有核细胞数或骨髓细胞DNA含量为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
任一剂量组与辐射模型对照组比较,骨髓有核细胞数或骨髓细胞DNA含量增多,差异有显著性,则可判定该实验阳性。
3 小鼠骨髓细胞微核实验
3.1 原理
骨髓细胞微核数增高是一次性全身γ射线照射引起辐射损伤的表现之一,在一定范围内,照射剂量与骨髓细胞微核率成正比,恢复时间与骨髓细胞微核率成反比,骨髓细胞微核数可代表机体染色体受损的状况。
3.2 仪器和试剂
解剖器械,生物显微镜,载玻片等。
小牛血清:小牛血清滤菌后放入56℃恒温水浴保温1h进行补体活性灭活。-20℃保存。亦可用大、小鼠血清代替。
Giemsa染液及应用液
1/15mol/L磷酸盐缓冲液(pH6.8)
甲醇(分析纯)
3.3 实验方法
3.3.1 实验动物:小鼠,体重18-22g,单一性别,每组10-15只。
3.3.2 剂量分组及受试样品给予时间
实验设三个剂量组和一个辐射模型对照组,以人体推荐量的10倍为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。受试样品于照射前给予14-30天,照射后仍然给予受试物,必要时可适当延长至45天。
3.3.3 实验步骤:
受试样品组于照射前后经口连续给予受试样品,剂量组与辐射模型对照组均以同一剂量γ射线全身照射一次,照射剂量宜选择3Gy-5Gy。于照射后第3天,颈椎脱臼处死动物,取胸骨或股骨,用止血钳挤出骨髓液与玻片一端的小牛血清混匀,常规涂片。或用小牛血清冲洗股骨骨髓腔制成细胞悬液涂片,涂片自然干燥后,放入甲醇中固定5-10min,放入Giemsa应用液中,染色10-15min,立即用磷酸盐缓冲液或蒸馏水冲洗,晾干。镜检,每只动物计数1000个嗜多染红细胞中微核细胞数,微核率以千分率表示。
抑制率计算:

3.4 数据处理及结果判定
采用卡方检验、泊松分布或方差分析等统计方法进行数据处理。
任一剂量组微核率低于辐射模型对照组微核率,差异有显著性,可判定该实验结果阳性。
4 血/组织中超氧化物歧化酶(SOD)活性实验
4.1 原理
血/组织中超氧化物歧化酶(SOD)活性降低是一次性全身γ射线照射引起辐射损伤的表现之一,在一定范围内,照射剂量与血/组织中超氧化物歧化酶(SOD)活性成反比,恢复时间与血/组织中超氧化物歧化酶(SOD)活性成正比,血/组织中超氧化物歧化酶(SOD)活性可代表机体氧化还原反应系统受损的状况。
O2-氧化羟基的最终产物为亚硝酸盐,后者在对氨基苯磺酸及甲萘胺作用下呈现紫红色,在波长530nm
处有最大吸收峰,可用分光光度法进行测定,当SOD消除O2-后形成的亚硝酸盐减少。
4.2 仪器与试剂
仪器721分光光度计、离心机、恒温水浴、匀浆器
试剂
1/15mol/L磷酸盐缓冲液(PBS)pH7.8、SOD标准品、三氯甲烷、95%乙醇(v/v)、0.9%生理盐水
10mmol/L盐酸羟胺
盐酸羟胺6.95mg,加PBS至10mL
7.5mmol/L黄嘌呤
黄嘌呤11.41mg,加0.1MNaOH2.5mL溶解,加PBS至10mL
0.2mg/mL黄嘌呤氧化酶
取10mg/mL黄嘌呤氧化酶0.2mL加冰冷PBS9.8mL至10mL
0.1%甲萘胺
取0.2gα-甲萘胺溶于40mL沸蒸馏水,凉至室温加50mL冰醋酸,再加110mL凉蒸馏水至200mL
0.33%对氨基苯磺酸
取0.66g对氨基苯磺酸溶于150mL温蒸馏水,加50mL冰醋酸至200mL
4.3 实验方法
4.3.1 实验动物:小鼠,体重18-22g,单一性别,每组10-15只。
4.3.2 剂量分组及受试样品给予时间
实验设三个剂量组和一个辐射模型对照组,以人体推荐量的10倍为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。受试样品于照射前给予14-30天,照射后仍然给予受试物,必要时可适当延长至45天。
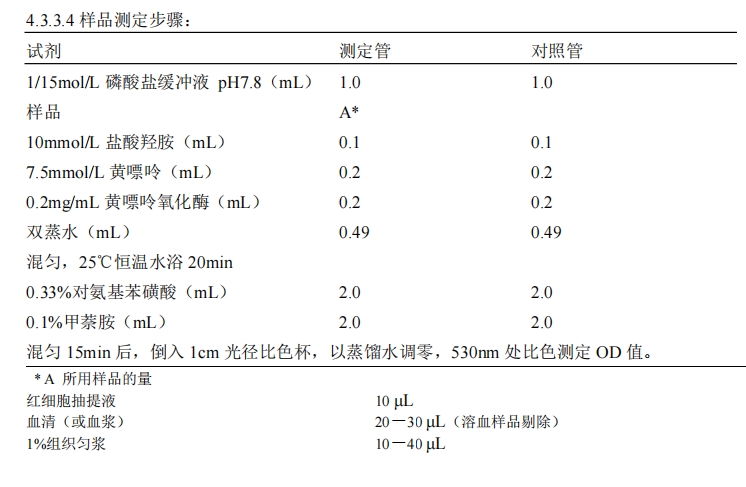
4.3.3 实验步骤
受试样品组于照射前后经口连续给予受试样品,剂量组与辐射模型对照组均以同一剂量γ射线全身照射一次,照射剂量宜选择6Gy-8Gy。于照射后第7天,进行实验。
4.3.3.1 红细胞抽提液制备:10μL全血冲入0.5mL生理盐水,2000r/min离心3min,弃上清,加冰冷的双蒸水0.2mL混匀,加入95%乙醇0.1mL,振荡30s,加入三氯甲烷0.1mL,置快速混合器抽提1min,4000r/min离心3min,分层,上层为SOD抽提液,中层为血红蛋白沉淀物,下层为三氯甲烷,记录上清液体积待测。
4.3.3.2 组织匀浆的制备:剪取一定量的所需脏器,生理盐水冲洗、拭干、称重、剪碎,至玻璃匀浆器中加入冷生理盐水20000r/min匀浆10s,间歇30s,反复进行三次,制成1%组织匀浆,(最好用超声波发生器处理30s),使线粒体振破,以中性红-詹钠氏绿B染色证明线粒体已振碎。以4000r/min离心5min,取上清液20μL待测。
4.3.3.3 SOD标准抑制曲线将SOD标准品用磷酸盐缓冲液配制成750U/mL的溶液,再稀释到50倍,即SOD量为15U/mL(1.5μg/mL),用本法测定不同量的SOD标准液的百分抑制率,以百分抑制率为纵坐标,以SOD活力单位U/mL为横坐标绘制标准曲线。

计算
每mL反应液中SOD抑制率达50%时所对应的SOD量为一个单位。
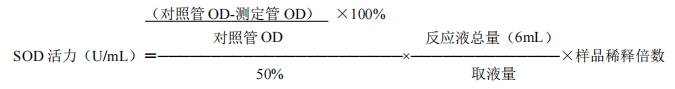
也可用酶比活法即以每管样品的百分抑制率从SOD标准曲线查出相应的SODU/mL,乘以稀释倍数(1mL/取样量)。
若样品为组织匀浆液,根据匀浆浓度或组织蛋白质含量,将单位换算为U/g组织或U/mg蛋白。若样品为红细胞抽提液,根据血红蛋白含量,可换算为U/gHb。
4.4 数据处理及结果判定
SOD活性值为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
任一剂量组与辐射模型对照组比较,血/组织中SOD活性增强,差异有显著性,则可判定该实验阳性。
5 血清溶血素实验
5.1 原理
免疫系统是机体辐射损伤较敏感的组织之一,血清溶血素值可代表体液免疫系统的状况。在一定范围内,照射剂量与血清中溶血素水平成反比,恢复时间与血清中溶血素水平成正比,血清中溶血素可代表机体体液免疫系统受损的状况。
5.2 实验方法
5.2.1 实验动物:小鼠,18-22g,单一性别,每组10-15只。
5.2.2 剂量分组及受试样品给予时间
实验设三个剂量组和一个辐射模型对照组,以人体推荐量的10倍为其中的一个剂量组,另设二个剂量组,必要时设阳性对照组。受试样品于照射前给予14-30天,照射后仍然给予受试物,必要时可适当延长至45天。
5.2.3 实验步骤
受试样品组于照射前后经口连续给予受试样品,剂量组与辐射模型对照组均以同一剂量γ射线全身照射一次,照射剂量宜选择1Gy-3Gy。于照射后20天内,进行血清溶血素的测定。(可任选下列方法之一)
5.2.3.1 血凝法
5.2.3.1.1 原理
用SRBC免疫动物后,产生抗SRBC抗体(溶血素),利用其凝集SRBC的程度来检测溶血素的水平。
5.2.3.1.2 仪器和材料
SRBC、生理盐水、微量血凝实验板、离心机。
5.2.3.1.3 实验步骤
5.2.3.1.3.1 SRBC绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中,朝一个方向摇动,以脱纤维,放入4℃冰箱保存备用,可保存2周。
5.2.3.1.3.2 免疫动物及血清分离取羊血,用生理盐水洗涤3次,每次离心(2000r/min)10min。将压积SRBC用生理盐水配成2%(v/v)的细胞悬液,每只鼠腹腔注射0.2mL进行免疫。4~5天后,摘除眼球取血于离心管内,放置约1h,将凝固血与管壁剥离,使血清充分析出,2000r/min离心10min,收集血清。
5.2.3.1.3.3 凝集反应用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100μL,再加入100μL0.5%(v/v)的SRBC悬液,混匀,装入湿润的平盘内加盖,于37℃温箱孵育3h,观察血球凝集程度。
血清凝集程度一般分为5级(0-IV)记录,按下式计算抗体积数,抗体水平=(S1+2S2+3S3……nSn)式中1、2、3……n代表对倍稀释的指数,S代表凝集程度的级别,抗体积数越大,表示血清抗体越高。
0级 红细胞全部下沉,集中在孔底部形成致密的圆点状,四周液体清晰。
I级 红细胞大部分沉集在孔底成圆点状,四周有少量凝集的红细胞。
II级 凝集的红细胞在孔底形成薄层,中心可以明显见到一个疏松的红点。
III级 凝集的红细胞均匀地铺散在孔底成一薄层,中心隐约可见一个小红点。
IV级 凝集的红细胞均匀地铺散在孔底成一薄层,凝块有时成卷折状。
5.2.3.1.4 数据处理及结果判定
抗体积数为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
受试样品组的抗体积数显著高于模型对照组的抗体水平,可判定该项实验结果阳性。
5.2.3.1.5 注意事项
血清稀释时要充分混匀。最后一个稀释度应不出现凝集现象。
5.2.3.2 半数溶血值(HC50)的测定
5.2.3.2.1 原理
用SRBC免疫动物后,产生抗SRBC抗体(溶血素),与SRBC一起孵育,在补体参与下,可发生溶血反应,释放血红蛋白,通过测定血红蛋白含量反映动物血清中溶血素的含量。
5.2.3.2.2 仪器和材料
721分光光度计、离心机、恒温水浴、SRBC、补体(豚鼠血清)、SA缓冲液、都氏试剂(碳酸氢钠1.0g、高铁氰化钾0.2g、氰化钾0.05g,加蒸馏水至1000mL)。
5.2.3.2.3 实验步骤
5.2.3.2.3.1SRBC 绵羊颈静脉取血,将羊血放入有玻璃珠的灭菌锥形瓶中朝一个方向摇动,以脱纤维,放入4℃冰箱保存备用,可保存2周。
5.2.3.2.3.2 制备补体采集豚鼠血,分离出血清(至少5只豚鼠的混合血清),将1mL压积SRBC加入到5mL豚鼠血清中,放4℃冰箱30min,经常振荡,离心取上清,分装,-70℃保存。用时以SA液按1∶8稀释。
5.2.3.2.3.3 免疫动物及血清分离取羊血,用生理盐水洗涤3次,每次离心(2000r/min)10min。将压积SRBC用生理盐水配成2%(v/v)的细胞悬液,,每只鼠腹腔注射0.2mL进行免疫。4~5天后,摘除眼球取血于离心管内,放置约1h,使血清充分析出,2000r/min离心10min,或6000r/min,4min,收集血清。
5.2.3.2.3.4 溶血反应取血清用SA缓冲液稀释(一般为200~500倍)。将稀释后的血清1mL置试管内,依次加入10%(v/v)SRBC0.5mL,补体1mL(用SA液按1:8稀释)。另设不加血清的对照管(以SA液代替)。置37℃恒温水浴中保温15~30min后,冰浴终止反应。2000r/min离心10min。取上清液1mL,加都氏试剂3mL,同时取10%(v/v)SRBC0.25mL加都氏试剂至4mL,充分混匀,放置10min后,于540nm处以对照管作空白,分别测定各管光密度值。
溶血素的量以半数溶血值(HC50)表示,按下列公式计算,

5.2.3.2.4 数据处理及结果判定
血清溶血素含量为计量资料,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
任一剂量组与辐射模型对照组比较,血清半数溶血值增多,差异有显著性,则可判定该实验阳性。
结果判定
在外周血中白细胞计数实验、骨髓细胞DNA含量或骨髓有核细胞数实验、小鼠骨髓细胞微核实验、血/组织中超氧化物歧化酶活性实验、血清溶血素含量实验中,任何两项实验结果阳性,可判定该受试样品具有对电离辐射危害有辅助保护作用。
